题目内容
14.已知一定条件下,黄铁矿与硫酸铁溶液反应的化学方程式为FeS2+7Fe2(SO4)3+8H2O═15FeSO4+8H2SO4,下列说法错误的是( )| A. | FeS2是还原剂,发生氧化反应 | |
| B. | FeSO4是还原产物 | |
| C. | 每生成1molH2SO4,转移14mol电子 | |
| D. | 反应中H2O既不是氧化剂也不是还原剂 |
分析 FeS2+7Fe2(SO4)3+8H2O═15FeSO4+8H2SO4中,S元素的化合价由-1价升高为+6价,Fe元素的化合价由+3价降低为+2价,以此来解答.
解答 解:A.FeS2中S元素的化合价升高,作还原剂,发生氧化反应,故A正确;
B.Fe2(SO4)3中Fe元素的化合价降低,被还原,对应还原产物为FeSO4,故B正确;
C.由反应可知,生成8molH2SO4时转移14mol电子,故C错误;
D.水中H、O元素的化合价不变,则反应中H2O既不是氧化剂也不是还原剂,故D正确;
故选C.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
5.下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 使甲基橙变红色的溶液:Mg2+、K+、SO42-、NO3- | |
| B. | PH=13的溶液:Na+、Cu2+、HCO3-、NO3- | |
| C. | 水电离出的c(H+)=10-12mol/L的溶液:K+、Na+、CO32-、Br- | |
| D. | 有较多Fe3+的溶液中:Na+、NH4+、SCN-、HCO3- |
2.以下叙述中错误的是( )
| A. | 钠原子与氯气反应生成食盐后,其结构的稳定性增强 | |
| B. | 第IA族的元素与卤素结合时,一定形成离子键 | |
| C. | 任何单质在离子键的形成过程中必定有电子的得与失 | |
| D. | 钠与氧气反应生成氧化钠后,体系的能量降低 |
6.6g碳和8g氧气高温下在一密闭容器中充分反应,若碳和氧气均反应完全,则所得气体产物是( )
| A. | 14g CO2 | B. | 1lg CO2、3g CO | C. | CO、CO2各7g | D. | 14g CO |
3.用氢氧化钠固体配制0.10mol/L的氢氧化钠溶液,下列说法中错误的是( )
| A. | 定容时俯视容量瓶刻度线,会造成所配溶液浓度偏大 | |
| B. | 移液时不慎有部分液体溅出,会造成所配溶液浓度偏小 | |
| C. | 称量时托盘上要垫上干净的称量纸 | |
| D. | 定容摇匀后发现液面下降,不应再加蒸馏水 |
4.
| 物质 | 分子数 | 质量/g | 物质的量/mol | 摩尔质量/g•mol-1 |
| O2 | 8.0 | |||
| H2SO4 | 3.01×1023 | |||
| H2O | 0.5 |
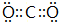 ;
;