题目内容
【题目】我国是最早发现并使用锌的国家,《天工开物》记载了炉甘石(ZnCO3)和木炭冶炼锌。现代工业上用氧化锌烟灰(主要成分为ZnO 、少量Pb、CuO和As2O3)制取高纯锌的工艺流程如图所示。
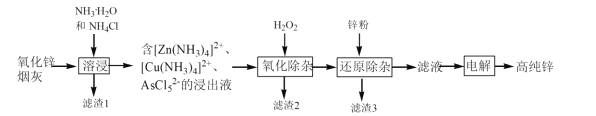
请回答下列问题:
(1)《天工开物》中炼锌的方法中利用了木炭的____ 性。
(2)滤渣1和滤渣3的主要成份分别是______、______(填化学式)。
(3)“溶浸”时,氧化锌参与反应的相关离子方程式是______;“溶浸”时温度不宜过高,其原因是______。
(4)“氧化除杂”的目的是将AsCl52-转化为As2O5胶体,再经吸附聚沉除去,该反应的离子方程式是______。
(5)“电解”含 [Zn(NH3)4]2+的溶液,阴极放电的电极反应式是______。阳极区产生一种无色无味的气体,将其通入滴有KSCN的FeCl2溶液中,无明显现象,该气体是_____(写化学式)。该流程中可以循环使用的物质是_____(写化学式)。
【答案】还原 Pb Cu ZnO+2NH3+2NH4+=[Zn(NH3)4]2++H2O或ZnO+2NH3H2O +2NH4+=[Zn(NH3)4]2++3H2O 避免氨水的分解与挥发 2AsCl52-+2H2O2+H2O=As2O5(胶体)+1OCl-+6H+ [Zn(NH3)4]2++2e-= Zn+4NH3↑ N2 NH4Cl(或NH3H2O和NH4Cl)
【解析】
(1)《天工开物》中炼锌,发生的氧化还原反应为2ZnO+C![]() 2Zn+CO2↑。
2Zn+CO2↑。
(2)根据流程可知氧化锌烟灰中Zn,Cu,As三种元素都形成配合物了,故滤渣1为Pb,加入锌粉把铜置换出来,故滤渣3为Cu。
(3)“溶浸”时,氧化锌参与反应的相关离子方程式是ZnO+2NH3+2NH4+=[Zn(NH3)4]2++H2O或ZnO+2NH3 H2O +2NH4+=[Zn(NH3)4]2++3H2O;氨水受热易挥发和分解,故“溶浸”时温度不宜过高。
(4)H2O2具有氧化性,把AsCl52-转化为As2O5胶体。
(5)[Zn(NH3)4]2+在阴极得电子被还原,放电的电极反应式是[Zn(NH3)4]2++2e-= Zn+4NH3↑,
阳极区氯离子放电生成氯气,氯气把氨氧化生成了氮气。
(1)《天工开物》中炼锌,发生的氧化还原反应为2ZnO+C![]() 2Zn+CO2↑,利用了木炭的还原性,故答案为:还原。
2Zn+CO2↑,利用了木炭的还原性,故答案为:还原。
(2)根据流程可知氧化锌烟灰中Zn,Cu,As三种元素都形成配合物了,故滤渣1为Pb,加入锌粉把铜置换出来,故滤渣3为Cu,故答案为:Pb,Cu。
(3)“溶浸”时,氧化锌参与反应的相关离子方程式是ZnO+2NH3+2NH4+=[Zn(NH3)4]2++H2O或ZnO+2NH3 H2O +2NH4+=[Zn(NH3)4]2++3H2O;氨水受热易挥发和分解,故“溶浸”时温度不宜过高,故答案为:ZnO+2NH3+2NH4+=[Zn(NH3)4]2++H2O或ZnO+2NH3 H2O +2NH4+=[Zn(NH3)4]2++3H2O;避免氨水的分解与挥发。
(4)H2O2具有氧化性,把AsCl52-转化为As2O5胶体,反应的离子方程式为2AsCl52-+2H2O2+H2O=As2O5(胶体)+1OCl-+6H+,故答案为:2AsCl52-+2H2O2+H2O=As2O5(胶体)+1OCl-+6H+。
(5)[Zn(NH3)4]2+在阴极得电子被还原,放电的电极反应式是[Zn(NH3)4]2++2e-= Zn+4NH3↑,
阳极区氯离子放电生成氯气,氯气把氨氧化生成了氮气,该流程中可以循环使用的物质是NH4Cl(或NH3H2O和NH4Cl),故答案为:[Zn(NH3)4]2++2e-= Zn+4NH3↑;N2;NH4Cl(或NH3H2O和NH4Cl)。

 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案【题目】已知化学反应①:Fe(s)+CO2(g)![]() FeO(s)+CO(g),其化学平衡常数为K1;化学反应②:Fe(s)+H2O(g)
FeO(s)+CO(g),其化学平衡常数为K1;化学反应②:Fe(s)+H2O(g)![]() FeO(s)+H2(g),其化学平衡常数为K2,在温度973 K和1173 K的情况下,K1、K2的值分别如下:
FeO(s)+H2(g),其化学平衡常数为K2,在温度973 K和1173 K的情况下,K1、K2的值分别如下:
温度 | K1 | K2 |
973 K | 1.47 | 2.38 |
1 173 K | 2.15 | 1.67 |
(1)通过表格中的数值可以推断:反应①是_______(填“吸热”或“放热”)反应。
(2)现有反应③:CO2(g)+H2(g)![]() CO(g)+H2O(g),请你写出该反应的平衡常数K3的表达式:K3=______。
CO(g)+H2O(g),请你写出该反应的平衡常数K3的表达式:K3=______。
(3)根据反应①与②可推导出K1、K2与K3之间的关系式为__________,据此关系式及上表数据,能推断出反应③是________(填“吸热”或“放热”)反应。
(4)要使反应③在一定条件下建立的平衡向正反应方向移动,可采取的措施有______ 、_____ (填写字母序号)。
A.缩小反应容器的容积 B.扩大反应容器的容积
C.升高温度 D.使用合适的催化剂
E.设法减小平衡体系中的CO的浓度
(5)图甲、乙分别表示反应③在t1时刻达到平衡,在t2时刻因改变某个条件而发生变化的情况:

①图甲中t2时刻发生改变的条件是__________。
②图乙中t2时刻发生改变的条件是__________。