题目内容
18.下列各组物质中:①Cl2O7 HClO,②SO2 H2SO4,③NO2 HNO3,④SiO2 H4SiO4,⑤Mn2O7 HMnO4,前者是后者的酸酐,正确的是( )| A. | ②③ | B. | ③④ | C. | ④⑤ | D. | ①③④ |
分析 某酸脱去一分子水或几分子水,所剩下的部分称为该酸的酸酐,其酸酐中决定酸性的元素的化合价不变,据此判断.
解答 解:①Cl2O7 HClO,氧化物中氯元素化合价为+7价,次氯酸中氯元素化合价+1价,前者不是后者的酸酐,故①错误;
②SO2 H2SO4,二氧化硫中硫元素化合价+4价,硫酸中硫元素化合价为+6价,前者不是后者的酸酐,故②错误;
③NO2 HNO3,二氧化氮中氮元素化合价为+4价,硝酸中氮元素化合价+5价,前者不是后者的酸酐,故③错误;
④SiO2 H4SiO4,二氧化硅中硅元素化合价和原硅酸中硅元素化合价都是+4价,前者是后者的酸酐,故④正确;
⑤Mn2O7 HMnO4,氧化物中锰元素化合价和高锰酸中锰元素化合价都是+7价,前者是后者的酸酐,故⑤正确;
故选C.
点评 本题考查利用化合价来判断酸对应的酸酐,硫酸和对应的酸酐中硫元素的化合价相同是解答本题的关键,题目较简单.

练习册系列答案
相关题目
8.某有机物的结构简式如图,下列关于该有机物的叙述不正确的是( )
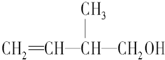

| A. | 能与金属钠反应并放出氢气 | |
| B. | 能在催化剂作用下与H2发生加成反应 | |
| C. | 能发生银镜反应 | |
| D. | 在浓H2SO4催化下能与乙酸发生酯化反应 |
9.能正确表示下列反应的离子方程式是( )
| A. | 铁跟盐酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| B. | 磷酸二氢钙溶液跟氢氧化钙溶液反应 H2PO4-+2OH-═PO43-+2H2O | |
| C. | 碳酸钙跟醋酸反应:CaCO3+2CH3COOH═Ca2++2CH3COO-+H2O+CO2↑ | |
| D. | 铜片跟稀硝酸反应 Cu+NO3-+4H+═Cu2++NO↑+2H2O |
13.一种有机玻璃的结构简式为 ,关于它的叙述不正确的是( )
,关于它的叙述不正确的是( )
 ,关于它的叙述不正确的是( )
,关于它的叙述不正确的是( )| A. | 该有机玻璃的化学名称为聚甲基丙烯酸甲酯 | |
| B. | 该有机玻璃可用2-甲基-丙烯酸和甲醇为原料,通过酯化反应、加聚反应制得 | |
| C. | 等物质的量的有机玻璃和2-甲基-丙烯酸甲酯耗氧量相同 | |
| D. | 其在一定条件下发生水解反应时,可得到另外一种高分子化合物 |
3.实验室保存下列试剂,其保存方法和理由描述都正确的是( )
| A. | 固体NaOH,存放在带有橡皮塞的广口瓶中,防止与空气接触被氧化 | |
| B. | 碳酸钠晶体,存放在干燥密封的广口瓶中,防止风化而碎裂成粉末 | |
| C. | 金属钠,存放在有水的广口瓶中,防止氧化 | |
| D. | 过氧化钠粉末,存放在带玻璃塞的细口瓶中,防止吸收水分而变质 |
2.(Ⅰ)六种短周期元素在元素周期表中的相对位置如图所示,其中R元素的最外层电子数是次外层电子数的一半,请回答下列问题:
(1)画出R的原子结构示意图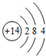 .
.
(2)比较Z、W的简单氢化物沸点高低并说明原因沸点H2O>H2S,由于H2O分子之间存在氢键.
(3)W和Y形成的一种化合物甲的相对分子质量为184,其中Y的质量分数约为30%,则化合物甲的化学式为N4S4.
(Ⅱ)聚合硫酸铁简称聚铁[Fe2(OH)n(SO4)(3-0.5n)]m(n>2,m≤10),是一种高效的无极高分子混凝剂,净水剂,实验室利用硫酸亚铁制取聚合硫酸铁的主要流程如下:
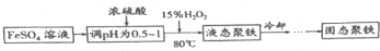
(4)FeSO4溶液显弱酸性的原因是Fe2++2H2O?2H++Fe(OH)2(用离子方程式表示)
(5)加入浓硫酸调节pH的作用是:①抑制Fe2+水解;②提高H2O2的氧化能力(或促进Fe2+被氧化).
(6)写出用上述流程得到某聚铁[Fe2(OH)4SO4]4的化学方程式8FeSO4+4H2O2+8H2O$\frac{\underline{\;\;△\;\;}}{\;}$[Fe2(OH)4SO4]4+4H2SO4.
(7)测定聚铁中含铁量的方法为把聚铁溶于过量酸中,先用过量的SnCl2将Fe3+还原成Fe2+,再加入HgCl2溶液除去过量的SnCl2,然后用标准的K2Cr2O7溶液(先加入几滴试亚铁灵指示剂)滴定溶液中的Fe2+.此过程发生的部分反应为:
Sn2++2Hg2++8Cl-═Hg2Cl2↓+SnCI62-
Cr2O22-+14H++6Fe2+═2Cr3++6Fe3++7H2O
①用HgCl2除去过量的SnCl2的目的是防止滴定过程中由于Sn2+同时还原Cr2O72-而造成较大的实验误差.
②称取聚铁质量为10.00g配成100.0mL溶液,取出20.00mL,经上述方法处理后,用0.1000mol•L-1K2Cr2O7标准溶液滴定,达到终点时,消耗K2Cr2O7标准溶液12.80mL,则聚铁中铁元素的质量分数为21.5%.
| X | Y | Z | M |
| R | W |
 .
.(2)比较Z、W的简单氢化物沸点高低并说明原因沸点H2O>H2S,由于H2O分子之间存在氢键.
(3)W和Y形成的一种化合物甲的相对分子质量为184,其中Y的质量分数约为30%,则化合物甲的化学式为N4S4.
(Ⅱ)聚合硫酸铁简称聚铁[Fe2(OH)n(SO4)(3-0.5n)]m(n>2,m≤10),是一种高效的无极高分子混凝剂,净水剂,实验室利用硫酸亚铁制取聚合硫酸铁的主要流程如下:

(4)FeSO4溶液显弱酸性的原因是Fe2++2H2O?2H++Fe(OH)2(用离子方程式表示)
(5)加入浓硫酸调节pH的作用是:①抑制Fe2+水解;②提高H2O2的氧化能力(或促进Fe2+被氧化).
(6)写出用上述流程得到某聚铁[Fe2(OH)4SO4]4的化学方程式8FeSO4+4H2O2+8H2O$\frac{\underline{\;\;△\;\;}}{\;}$[Fe2(OH)4SO4]4+4H2SO4.
(7)测定聚铁中含铁量的方法为把聚铁溶于过量酸中,先用过量的SnCl2将Fe3+还原成Fe2+,再加入HgCl2溶液除去过量的SnCl2,然后用标准的K2Cr2O7溶液(先加入几滴试亚铁灵指示剂)滴定溶液中的Fe2+.此过程发生的部分反应为:
Sn2++2Hg2++8Cl-═Hg2Cl2↓+SnCI62-
Cr2O22-+14H++6Fe2+═2Cr3++6Fe3++7H2O
①用HgCl2除去过量的SnCl2的目的是防止滴定过程中由于Sn2+同时还原Cr2O72-而造成较大的实验误差.
②称取聚铁质量为10.00g配成100.0mL溶液,取出20.00mL,经上述方法处理后,用0.1000mol•L-1K2Cr2O7标准溶液滴定,达到终点时,消耗K2Cr2O7标准溶液12.80mL,则聚铁中铁元素的质量分数为21.5%.
19.已知去甲肾上腺素可以调控动物机体的植物性神经功能,其结构简式如图所示.下列说法正确的是( )
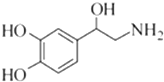

| A. | 去甲肾上腺素的分子式为C8H10O3N | |
| B. | 既能与FeCl3发生显色反应,也能和Na2CO3反应 | |
| C. | 1mol去甲肾上腺素最多能与2mol Br2发生取代反应 | |
| D. | 核磁共振氢谱显示应该有8种不同的氢原子. |
20.将0.5mol SO2(g)和0.3mol O2(g)放入容积为10L的密闭容器中,反应2SO2(g)+O2(g)?2SO3(g)在一定条件下达到平衡时测得n(SO3)=0.4mol,则该条件下反应的平衡常数K为( )
| A. | 160 | B. | 160mol-1 | C. | 1600mol•L-1 | D. | 1600L•mol-1 |