题目内容
【题目】氮有不同价态的氧化物,如NO、N2O3、NO2等,它们在一定条件下可以相互转化。
(1)某温度下,在一体积可变的密闭容器中充入1molN2O3,发生反应N2O3NO2(g)+NO(g),达到平衡后,于t1时刻改变某一条件后,速率与时间的变化图象如图1所示,有关说法
正确的是____
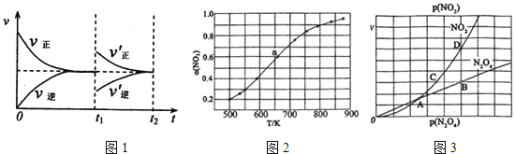
A.t1时刻改变的条件是增大N2O3的浓度,同时减小NO2或NO的浓度
B.t1时刻改变条件后,平衡向正反应方向移动,N2O3的转化率增大
C.在t2时刻达到新的平衡后,NO2的百分含量不变
D.若t1时刻将容器的体积缩小至原容积的一半,则速率~时间图象与上图相同
(2)在1000K下,在某恒容容器中发生下列反应:2NO2(g)2NO(g)+O2(g),将一定量的NO2放入恒容密闭容器中,测得其平衡转化率α(NO2)随温度变化如图所示。
图2中a点对应温度下。已知NO2的起始压强P0为120kPa,列式计算该温度下反应的平衡常数Kp=______(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(3)对于反应N2O4(g)2NO2(g),在一定条件下N2O4与NO2的消耗速率与自身压强间存在关系:v(N2O4)=k1p(N2O4),v(NO2)=k2p2(NO2).其中,k1、k2是与反应及温度有关的常数。相应的速率﹣压强关系如图所示:一定温度下,k1、k2与平衡常数Kp间的关系是k1=_____;在图3标出点中,指出能表示反应达到平衡状态的两个点_____,理由是____________________________。
【答案】C 81kPa ![]() K2Kp B、D N2O4与NO2的消耗速率满足条件v(NO2)=2v(N2O4)
K2Kp B、D N2O4与NO2的消耗速率满足条件v(NO2)=2v(N2O4)
【解析】
(1)利用等效平衡分析;
(2)三行式法计算;
(3)根据平衡常数表达式计算;根据达到化学平衡后,正逆反应速率比等于化学计量数之比判断。
(1)A.由速率与时间的变化图象可知,t1时刻改变某一条件后,反应N2O3(g)NO2(g)+NO(g)正反应速率增大,逆反应速率减小,最后平衡速率与原平衡相等,则改变的条件是增大N2O3的浓度,由于T、P相等,则容器体积增大,导致NO2、NO的浓度减小,但达到新平衡后与原平衡等效,故A错误;
B.t1时刻改变的条件是增大N2O3的浓度,由于T、P相等,则容器体积增大,导致NO2、NO的浓度减小,但达到新平衡后与原平衡等效,N2O3的转化率不变,故B错误;
C.t1时刻改变的条件是增大N2O3的浓度,由于T、P一定,则容器体积增大,导致NO2、NO的浓度减小,但达到新平衡后与原平衡等效,NO2的百分含量不变,故C正确;
D.若t1时刻将容器的体积缩小至原容器的一半,则压强增大,正逆反应速率都增大,所以速率~时间图象与上图不同,故D错误;
答案:C;
(2)图中a点对应温度下,NO2的转化率是0.6,设原来NO2的物质的量为xmol,转化的物质的量为0.6xmol;
2NO2(g) 2NO(g)+O2(g)
开始 x 0 0
转化0.6xmol 0.6xmol 0.3xmol
平衡0.4xmol 0.6xmol 0.3xmol
则混合气体的物质的量=0.4xmol+0.6xmol+0.3xmol=1.3xmol,相同条件下,气体的压强之比等于其物质的量之比,所以反应后压强=![]() ×1.3xmol=156KPa,NO2的分压=156KPa×
×1.3xmol=156KPa,NO2的分压=156KPa×![]() =48KPa,NO的分压=156KPa×
=48KPa,NO的分压=156KPa×![]() =72KPa,O2的分压=156KPa×
=72KPa,O2的分压=156KPa×![]() =36KPa;
=36KPa;
化学平衡常数Kp=![]() =
=![]() =81;
=81;
答案:81;
(3)反应N2O4(g)2NO2(g),则化学平衡常数Kp=![]() ,当二者的反应速率之比等于其计量数之比,反应达到平衡,则v(NO2):v(N2O4)=k2p2(NO2):k1p(N2O4)=2:1,又化学平衡常数Kp==
,当二者的反应速率之比等于其计量数之比,反应达到平衡,则v(NO2):v(N2O4)=k2p2(NO2):k1p(N2O4)=2:1,又化学平衡常数Kp==![]() ,所以K1=
,所以K1=![]() K2Kp,满足平衡条件v(NO2)=2v(N2O4)即为平衡点,B、D点的压强之比等于其反应速率之比为1:2,所以B、D为平衡点;
K2Kp,满足平衡条件v(NO2)=2v(N2O4)即为平衡点,B、D点的压强之比等于其反应速率之比为1:2,所以B、D为平衡点;
答案:![]() K2Kp ;B、D;N2O4与NO2的消耗速率满足条件v(NO2)=2v(N2O4)。
K2Kp ;B、D;N2O4与NO2的消耗速率满足条件v(NO2)=2v(N2O4)。