题目内容
【题目】分支酸用于生化研究,可以由物质A合成.已知:连4个不相同的原子或原子团的碳原子是手性碳原子.
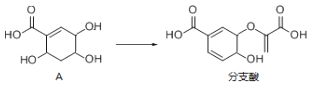
下列叙述不正确的是![]()
A.用![]() 溶液可鉴别化合物A和分支酸
溶液可鉴别化合物A和分支酸
B.化合物A中含有3个手性碳原子
C.1mol分支酸在一定条件下最多可与![]() 发生反应
发生反应
D.在浓硫酸和加热条件下,化合物A可发生消去反应生成多种有机产物
【答案】A
【解析】
A. 化合物A和分支酸均不含酚![]() ,均与氯化铁不反应,则不能鉴别,故A错误;
,均与氯化铁不反应,则不能鉴别,故A错误;
B. 与![]() 相连的3个C均连接4个不同的基团,则含有3个手性碳原子,故B正确;
相连的3个C均连接4个不同的基团,则含有3个手性碳原子,故B正确;
C. 分支酸中![]() 与碳酸氢钠反应,则1mol分支酸在一定条件下最多可与
与碳酸氢钠反应,则1mol分支酸在一定条件下最多可与![]() 发生反应,故C正确;
发生反应,故C正确;
D. 化合物A含3个![]() ,与
,与![]() 相连C的邻位C上有H,则在浓硫酸和加热条件下,化合物A可发生消去反应生成多种有机产物,故D正确;
相连C的邻位C上有H,则在浓硫酸和加热条件下,化合物A可发生消去反应生成多种有机产物,故D正确;
故选A。

【题目】高锰酸钾具有强氧化性,广泛用于化工、医药、采矿、金属治炼及环境保护领域等。KMnO4的制备是以二氧化锰(MnO2)为原料,在强碱性介质中被氧化生成墨绿色的锰酸钾(K2MnO4);然后在一定pH下K2MnO4歧化生成紫色KMnO4。回答下列问题
(1)K2MnO4的制备
实验步骤 | 现象或解释 |
①称取2.5 gKClO3固体和5.2gKOH固体置于铁坩埚中,加热熔融 | 不用瓷坩埚的原因是____________。 |
②分多次加入3gMnO2固体 | 不一次加入的原因是__________________。 |
(2)KMnO4的制备
趁热向K2MnO4溶液中加入1 mol/L H3PO4溶液,直至K2MnO4全部歧化,判断全部歧化的方法是用玻璃棒蘸取溶液于滤纸上,现象为_________________________。然后趁热过滤,将滤液倒入蒸发皿中加热到液面出现晶膜,充分冷却后过滤,在80℃烘箱中干燥3h,不选用更高温度的原因是_____________________________。
(3)产品分析
i.不同pH下产品中KMnO4含量
加入H3PO4体积/mL | 溶液的pH | 产品质量 | KMnO4质量 | KMnO4质量分数 |
10.50 | 12.48 | 2.35 | 2.05 | 87.23 |
12.50 | 11.45 | 2.45 | 2.18 | 88.98 |
14.50 | 10.89 | 2.18 | 1.87 | 85.78 |
16.50 | 10.32 | 2.28 | 1.75 | 76.75 |
18.50 | 9.44 | 2.09 | 1.48 | 70.81 |
从表格中数据分析,在歧化时选择溶液的最佳pH是________________。
ii.利用H2C2O4标准溶液测定KMnO4的纯度。测定步骤如下:
①溶液配制:称取1.000g的KMnO4固体样品,放入_____________中溶解,然后冷至室温后全部转移到100mL容量瓶中,加蒸馏水至刻度线。
②滴定:移取25 mLKMnO4溶液于锥形瓶中,加少量硫酸酸化,用0.1400mol/L的H2C2O4标准溶液滴定,发生反应:2MnO4-+5H2C2O4+6H+=2Mn2++10C02+8H2O,当溶液紫色褪色且半分钟内不变色即为终点,平行滴定3次,H2C2O4溶液的平均用量为23.90mL,则样品纯度为_______________%(保留1位小数)。
【题目】一定温度下,在2.5L的恒容密闭容器中发生如下反应:CO2(g)+H2S(g)![]() COS(g)+H2O(g)
COS(g)+H2O(g)
实验 | 温度/K | 起始物质的量/mol | 平衡物质的量/mol | 平衡常数 | |
CO2 | H2S | H2O | |||
I | 607 | 0.11 | 0.41 | 0.01 | |
II | 607 | 0.22 | 0.82 | ||
III | 620 | 0.1 | 0.4 | 6.74×10-3 | |
下列说法不正确的是( )
A. 该反应正反应为吸热反应
B. 607K时,把物质的量均为0.1mol四种反应物加入该反应器中,反应将向正反应方向进行
C. 实验Ⅱ达到平衡时容器中COS的物质的量为0.02mol
D. 实验Ⅲ中,无论是开始还是至化学平衡状态,混合气体的密度始终不变
【题目】下列关于实验的说法正确的是![]()
实验目的 | 实验方案 | |
A | 除去苯中溶有的苯酚 | 取苯与苯酚的混合液,加入浓溴水,过滤 |
B | 证明 | 将 |
C | 分离 | 将混合液倒入过滤器中过滤 |
D | 酸性: |
|
A.AB.BC.CD.D