题目内容
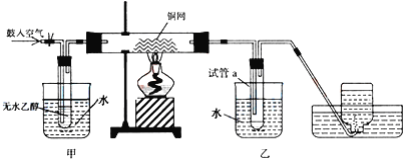
【题目】实验室制备硝基苯的实验装置如图所示(夹持装置已略去)。下列说法不正确的是
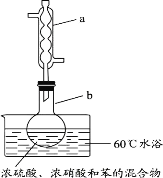
A.水浴加热的优点为使反应物受热均匀、容易控制温度
B.仪器a的作用是冷凝回流,提高原料的利用率
C.浓硫酸、浓硝酸和苯混合时,应先向浓硫酸中缓缓加入浓硝酸,待冷却至室温后,再将苯逐滴滴入
D.反应完全后,可用蒸馏的方法分离苯和硝基苯
【答案】C
【解析】
A.水浴加热的优点为使反应物受热均匀、容易控制温度,故A正确;
B.冷凝管可冷凝回流反应物,则仪器a的作用是冷凝回流,提高原料的利用率,故B正确;
C.混合时先加浓硝酸,后加浓硫酸,最后加苯,则混合时,应向浓硝酸中加入浓硫酸,待冷却至室温后,再将所得混合物加入苯中,故C错误;
D.苯和硝基苯相互混溶,可根据沸点差异利用蒸馏的方法分离苯和硝基苯,故D正确;
故选C。

【题目】已知2A(g)+B(g)![]() 2C(g) ΔH=-a kJ·mol-1(a>0),在一个有催化剂的固定容积的容器中加入2 mol A和1 mol B,在500 ℃时充分反应达平衡后,C的浓度为ω mol·L-1,放出的热量为b kJ。
2C(g) ΔH=-a kJ·mol-1(a>0),在一个有催化剂的固定容积的容器中加入2 mol A和1 mol B,在500 ℃时充分反应达平衡后,C的浓度为ω mol·L-1,放出的热量为b kJ。
(1)已知:A(g)+X(g)![]() 2B(g) ΔH=-133.2 kJ·mol-1;5A(g)+X(g)
2B(g) ΔH=-133.2 kJ·mol-1;5A(g)+X(g)![]() 4C(g) ΔH=-650.4 kJ·mol-1。则a=________。
4C(g) ΔH=-650.4 kJ·mol-1。则a=________。
(2)不同温度下该反应的平衡常数如表所示。
由此可推知,表中T1________T2(填“>”“=”或“<”)。
T/K | T1 | T2 | T3 |
K | 1.00×107 | 2.45×105 | 1.88×103 |
若在原来的容器中,只加入2 mol C,500 ℃时充分反应达平衡后,吸收热量为c kJ,C的浓度_________ω mol·L-1(填“>”“=”或“<”),a、b、c之间的关系为________。
(3)在相同条件下要想得到2a kJ热量,加入各物质的物质的量可能是________(填序号)。
A.4 mol A和2 mol B
B.4 mol A、2 mol B和2 mol C
C.4 mol A和4 mol B
D.6 mol A和4 mol B
(4)若将上述容器改为恒压容器(反应前体积相同),起始时加入2 mol A和1 mol B,500 ℃时充分反应达平衡后,放出的热量为d kJ,则d________b(填“>”“=”或“<”)。
(5)在一定温度下,向一个容积可变的容器中,通入3 mol A和2 mol B及固体催化剂,充分反应,平衡时容器内气体物质的量为起始时的90%。保持同一反应温度,在相同容器中,将起始物质的量改为4 mol A、3 mol B和2 mol C,则平衡时A的百分含量________(填“增大”“减小”或“不变”)
【题目】下列关于实验的说法正确的是![]()
实验目的 | 实验方案 | |
A | 除去苯中溶有的苯酚 | 取苯与苯酚的混合液,加入浓溴水,过滤 |
B | 证明 | 将 |
C | 分离 | 将混合液倒入过滤器中过滤 |
D | 酸性: |
|
A.AB.BC.CD.D