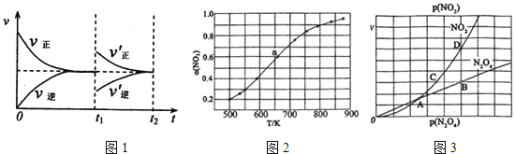
题目内容
【题目】有关物质的转化关系如图所示。A的摩尔质量为120 g·mol1且只含两种元素。B、E是常见气体,其中B为单质,E能使品红溶液褪色。D为红棕色固体,F为紫红色金属,C的浓溶液可干燥某些气体。

(1)A的化学式为______。
(2)H的电子式为______。
(3)写出反应③的离子方程式:______。
(4)写出反应④的化学方程式:______。
【答案】FeS2 ![]() 2Fe3++Cu=2Fe2++Cu2+ Fe2(SO4)3+SO2+2H2O=2FeSO4+2H2SO4
2Fe3++Cu=2Fe2++Cu2+ Fe2(SO4)3+SO2+2H2O=2FeSO4+2H2SO4
【解析】
E是常见气体,且E能使品红溶液褪色,则首先考虑E为SO2;D为红棕色固体,则D为Fe2O3;A只含两种元素,B是常见气体,且B为单质,A和B煅烧生成SO2和Fe2O3,则B为O2,A含有Fe、S两种元素,而A的摩尔质量为120 g·mol1,则A为FeS2;C的浓溶液可干燥某些气体,则C为硫酸,Fe2O3与H2SO4反应生成Fe2(SO4)3和水,F为紫红色金属,则F为Cu,Cu可以与Fe2(SO4)3反应生成CuSO4、FeSO4,则G为Fe2(SO4)3,H为H2O;Fe2(SO4)3、H2O、SO2反应生成FeSO4和H2SO4,则J为FeSO4,I为CuSO4,据此分析解答。
(1)由以上分析知,A为FeS2;
故答案为:FeS2;
(2)由以上分析知,H为H2O,其电子式为![]() ;
;
故答案为:![]() ;
;
(3)反应③为Cu与Fe2(SO4)3反应生成CuSO4、FeSO4,离子方程式为2Fe3++Cu=2Fe2++Cu2+;
故答案为:2Fe3++Cu=2Fe2++Cu2+;
(4)反应④为Fe2(SO4)3、H2O、SO2反应生成FeSO4和H2SO4,化学方程式为Fe2(SO4)3+SO2+2H2O=2FeSO4+2H2SO4;
故答案为:Fe2(SO4)3+SO2+2H2O=2FeSO4+2H2SO4。