题目内容
在密闭容器中发生下列反应;aA(g) cC(g)+dD(g),达到平衡后将气体体积压缩到原来的一半,当再次达到新平衡时,D的浓度为原来的1.8倍,下列说法正确的是
cC(g)+dD(g),达到平衡后将气体体积压缩到原来的一半,当再次达到新平衡时,D的浓度为原来的1.8倍,下列说法正确的是
①平衡向正反应方向移动了 ②平衡向逆反应方向移动了
③A的转化率增大 ④正、逆速率都增大
| A.②④ | B.①③ | C.③④ | D.①② |
A
解析试题分析:反应达到平衡后将气体体积压缩到原来的一半,假如平衡不发生移动,则D的浓度应该为原来的2倍。现在是原来的1.8倍,说明增大压强,化学平衡向逆反应方向移动。根据勒夏特列原理,增大压强,平衡向气体体积减小的方向移动。即逆反应方向是气体体积减小的方向。这时反应物的转化率降低。因为增大压强,各种物质的浓度都增大,所以正反应、逆反应的速率都增大。故正确说法为②④。选项为A。
考点:考查压强改变对反应速率和化学平衡的影响的知识。

 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案在一定条件下,将3 mol A和1 mol B两种气体混合于固定容积为2 L的密闭容器中,发生如下反应:3A(g)+B(g)  xC(g)+2D(g), 2 min后该反应达到平衡,生成0.8 mol D,并测得C的浓度为0.2 mol·L-1。则下列判断正确的是
xC(g)+2D(g), 2 min后该反应达到平衡,生成0.8 mol D,并测得C的浓度为0.2 mol·L-1。则下列判断正确的是
| A.x=2 |
| B.2 min内A的反应速率为0.6 mol·L-1·min-1 |
| C.B的转化率为40% |
| D.若混合气体的密度不变,则表明该反应达到平衡状态 |
在一密闭容器中充入一定量的N2和H2,经测定反应开始后的2s内氢气的平均速率:ν(H2)=0.45mol/(L·s),则2s末NH3的浓度为
| A.0.50mol/L | B.0.60mol/L | C.0.45mol/L | D.0.55mol/L |
一定量混合物在密闭容器中发生反应:mA(g)+nB(g) pC(g)达平衡后,将气体体积缩小到原来的1/2,当达到新的平衡时,B物质的浓度为原来的1.9倍,若压缩过程中保持温度不变,则下列说法正确的是
pC(g)达平衡后,将气体体积缩小到原来的1/2,当达到新的平衡时,B物质的浓度为原来的1.9倍,若压缩过程中保持温度不变,则下列说法正确的是
| A.m+n<p | B.平衡向逆反应方向移动 | C.A的转化率降低 | D.C的体积分数增大 |
下列说法正确的是
| A.△H <0 ,△S>0的反应在温度低时不能自发进行 |
| B.在其他条件不变时,增大反应物的浓度,可以增大活化分子百分数 |
| C.因为焓变和熵变都与反应的自发性有关,因此焓变或熵变均可以单独作为反应自发性的判据 |
| D.NH4HCO3(g)═NH3(g)+H2O(g)+CO2(g)△H = +185.57kJ/mol能自发进行,原因体系有自发地向混乱度增加的方向转变的倾向 |
化合物Bilirubin在一定波长的光照射下发生分解反应,反应物浓度随反应时间变化如下图所示,计算反应4~8 min间的平均反应速率和推测反应16 min时反应物的浓度,结果应是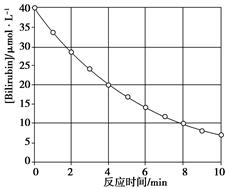
| A.2.5μmol·L-1·min-1和2.0μmol·L-1 |
| B.2.5μmol·L-1·min-1和2.5μmol·L-1 |
| C.3.0μmol·L-1·min-1和3.0μmol·L-1 |
| D.5.0μmol·L-1·min-1和3.0μmol·L-1 |
可逆反应aX(g)+bY(g)? ?cZ(g)在一定温度下的密闭容器内达到平衡后,t0时改变某一外界条件,化学反应速率(v)-时间(t)图像如图。下列说法正确的是( )
?cZ(g)在一定温度下的密闭容器内达到平衡后,t0时改变某一外界条件,化学反应速率(v)-时间(t)图像如图。下列说法正确的是( )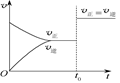
| A.若a+b=c,则t0时只能是增大反应体系的压强 |
| B.若a+b=c,则t0时只能是加入催化剂 |
| C.若a+b≠c,则t0时只能是加入催化剂 |
| D.若a+b≠c,则t0时只能是增大体系的压强 |
 2C(g) △H <0,下列各图正确的是( )
2C(g) △H <0,下列各图正确的是( )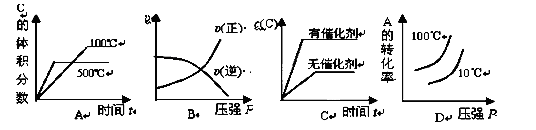
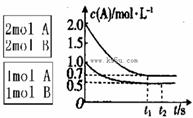
 xC(g)
xC(g) 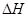 <0。测得两容器中c(A)随时间t的变化如图所示:
<0。测得两容器中c(A)随时间t的变化如图所示: