题目内容
在恒温、容积为2 L的密闭容器中充入2 mol SO2和一定量O2。发生反应2SO2+O2? ?2SO3,当反应进行到4 min时,测得n (SO2)=0.4 mol。若反应进行到2 min时,容器中SO2的物质的量是( )
?2SO3,当反应进行到4 min时,测得n (SO2)=0.4 mol。若反应进行到2 min时,容器中SO2的物质的量是( )
| A.等于1.6 mol | B.等于1.2 mol |
| C.大于1.6 mol | D.小于1.2 mol |
D
解析试题分析:首先该反应为可逆反应,且该反应为为总体积减小的反应(SO3为固体),随着反应进行,反应速率逐渐减慢。若按平均反应速率计算,则反应速率为(2mol-0.4mol )/2L×4min="0.2mol" /(L?min) 放反应进行2min时候,消耗SO2的物质的量0.2mol /(L?min)×2L×2min=0.8mol,剩余SO2的量应为1.2mol。但该反应是一个反应速率逐渐减慢的反应,故反应前半程,反应速率应大于平均反应速率,故消耗SO2应大于0.8mol,剩余SO2的物质的量应小于1.2mol。故选择D
考点:化学放映平衡速率计算及化学平衡移动与化学反应速率的关系。

在一密闭容器中充入一定量的N2和H2,经测定反应开始后的2s内氢气的平均速率:ν(H2)=0.45mol/(L·s),则2s末NH3的浓度为
| A.0.50mol/L | B.0.60mol/L | C.0.45mol/L | D.0.55mol/L |
化合物Bilirubin在一定波长的光照射下发生分解反应,反应物浓度随反应时间变化如下图所示,计算反应4~8 min间的平均反应速率和推测反应16 min时反应物的浓度,结果应是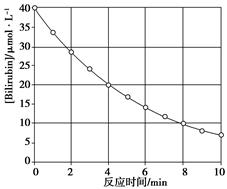
| A.2.5μmol·L-1·min-1和2.0μmol·L-1 |
| B.2.5μmol·L-1·min-1和2.5μmol·L-1 |
| C.3.0μmol·L-1·min-1和3.0μmol·L-1 |
| D.5.0μmol·L-1·min-1和3.0μmol·L-1 |
对于反应3Fe(s)+4H2O(g) Fe3O4(s)+4H2(g)的平衡常数,下列说法正确的是
Fe3O4(s)+4H2(g)的平衡常数,下列说法正确的是
A.K=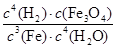 |
B.K=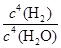 |
| C.增大c(H2O)或减小c(H2),会使该反应平衡常数减小 |
| D.改变反应的温度,平衡常数不一定变化 |
已知450℃时,反应H2(g)+I2(g) 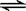 2HI(g)的K=50,由此推测在450℃时,反应2HI(g)
2HI(g)的K=50,由此推测在450℃时,反应2HI(g) 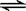 H2(g)+I2(g)的化学平衡常数为
H2(g)+I2(g)的化学平衡常数为
| A.50 | B.0.02 | C.100 | D.无法确定 |
可逆反应2NO2 2NO+O2在体积固定的密闭容器中,达到平衡状态的标志是
2NO+O2在体积固定的密闭容器中,达到平衡状态的标志是
①单位时间内生成n mol O2的同时生成2n mol NO2
②单位时间内生成n mol O2的同时生成2n mol NO
③用NO2,NO,O2表示的反应速率的比为2:2:1的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的压强不再改变的状态
⑦混合气体的平均相对分子质量不再改变的状态
| A.①④⑥⑦ | B.②③⑤⑦ | C.①③④⑤ | D.全部 |
可逆反应aX(g)+bY(g)?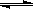 ?cZ(g)在一定温度下的密闭容器内达到平衡后,t0时改变某一外界条件,化学反应速率(v)-时间(t)图像如图。下列说法正确的是( )
?cZ(g)在一定温度下的密闭容器内达到平衡后,t0时改变某一外界条件,化学反应速率(v)-时间(t)图像如图。下列说法正确的是( )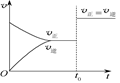
| A.若a+b=c,则t0时只能是增大反应体系的压强 |
| B.若a+b=c,则t0时只能是加入催化剂 |
| C.若a+b≠c,则t0时只能是加入催化剂 |
| D.若a+b≠c,则t0时只能是增大体系的压强 |
某温度下,将2 mol A和3 mol B充入一密闭容器中,发生反应:
aA(g)+B(g) C(g)+D(g),5 min后达到平衡.已知该温度下其平衡常数K=1,若温度不变时将容器的体积扩大为原来的10倍,A的转化率不发生变化,则 ( )
C(g)+D(g),5 min后达到平衡.已知该温度下其平衡常数K=1,若温度不变时将容器的体积扩大为原来的10倍,A的转化率不发生变化,则 ( )
| A.a=3 | B.a=2 | C.B的转化率为40% | D.B的转化率为60% |
已知反应X (g)+Y (g)  n Z (g) △H > 0,将X和Y以一定比例混合通入密闭容器中进行反应,各物质的浓度随时间的改变如图所示。下列说法不正确的是
n Z (g) △H > 0,将X和Y以一定比例混合通入密闭容器中进行反应,各物质的浓度随时间的改变如图所示。下列说法不正确的是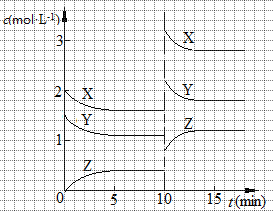
| A.反应方程式中n=1 |
| B.10 min时,曲线发生变化的原因是升高温度 |
| C.10 min时,曲线发生变化的原因是增大压强 |
| D.0~5 min内,用X表示的反应速率为v(X)="0.08" mol·L-1·min-1 |