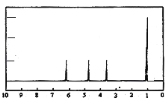
题目内容
【题目】铅蓄电池具有电压稳定,性能良好,安全可靠,循环使用等优点。其反应方程式如下式:Pb (s)+ PbO2(s) +2H2SO4(aq) ![]() 2PbSO4(s) +2H2O(l)。
2PbSO4(s) +2H2O(l)。
(1)放电时,负极发生_________反应(填“氧化”或“还原”),其电极反应式为______________________________,
(2)充电时,阳极发生___________反应(填“氧化”或“还原”),其电极反应式为_____________________________。
【答案】(1)氧化 Pb –2e-+SO42-= PbSO4 ;
(2)氧化 PbSO4 +2H2O –2e-= PbO2+4H++SO42-
【解析】
试题分析:(1)原电池,负极发生氧化反应,电极反应式为:Pb –2e-+SO42-= PbSO4 ,答案为:氧化 Pb –2e-+SO42-= PbSO4 ;
(2)充电时是电解池,阳极发生氧化反应,电极反应式为:PbSO4 +2H2O –2e-= PbO2+4H++SO42-,答案为:氧化 PbSO4 +2H2O –2e-= PbO2+4H++SO42-

【题目】(1)氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点。
已知:CH4(g)+H2O(g)=CO(g)+3H2(g) ΔH=+206.2 kJ·mol-1
CH4(g)+CO2(g)=2CO(g)+2H2(g) ΔH=+247.4 kJ·mol-1
2H2S(g)=2H2(g)+S2(g) ΔH=+169.8 kJ·mol-1
以甲烷为原料制取氢气是工业上常用的制氢方法。CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为 。
(2)Na2S的水溶液洗患处可以用来治疗由一种小芥虫在皮肤内生活引起的皮肤病,而且用热水配制的Na2S溶液治疗效果更好。请说明原因 ,并写出有关的化学方程式 。
(3)某自来水中含有Ca2+、Mg2+、Na+、K+、HCO、SO、Cl-,长期烧煮上述自来水会在锅炉内形成水垢。锅炉水垢不仅耗费燃料,而且有烧坏锅炉的危险,因此要定期清除锅炉水垢。
已知部分物质20 ℃时的溶解度数据:
物质 | Mg(OH)2 | CaCO3 | MgCO3 | Ca(OH)2 | CaSO4 | MgSO4 |
溶解度/(g/100 g H2O) | 9.0×10-4 | 1.5×10-3 | 1.0×10-2 | 1.7×10-1 | 2.1×10-1 | 26.7 |
①请用化学方程式表示锅炉中的水垢含有Mg(OH)2的原因:______________________。
②锅炉中的水垢所含有的CaSO4不能直接用酸除去,需要加入试剂X,使其转化为易溶于盐酸的物质Y而除去。试剂X是________(填序号)。
A.食醋 B.氯化钡 C.碳酸钠 D.碳酸氢钠
CaSO4能转化为物质Y的原因是(用文字叙述) _______________________________。