��Ŀ����
����Ŀ��I.����˵������ȷ���� ��
A����ϩ��������8���Ҽ���1���м�
B����SiO2�����У�1��Siԭ�Ӻ�2��Oԭ���γ�2�����ۼ�
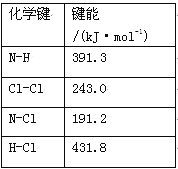
C��NF3�ķе��NH3�ķе�͵ö࣬����ΪNH3���Ӽ��������NF3ֻ�з��»���
D��NCl3��BC13�����У�����ԭ�Ӷ�����sp3�ӻ�
II.������ʹ�ý�������ʷ�����У�������ͭ��������֮�����ֽ����㷺Ӧ�õĽ�������ѧ��Ԥ������(Ti)��������Ϊ��δ�����͵Ľ��������Իش��������⣺
��1��TiԪ����Ԫ�����ڱ��е�λ���ǵ�______���ڵ�___ ____����
���̬ԭ�ӵĵ����Ų�ʽΪ________��
��2����Ti�Ļ������У����Գ��֣�2����3����4���ֻ��ϼۣ������ԣ�4�۵�Ti��Ϊ�ȶ���ƫ���ᱵ�����ȶ��Ժã���糣���ߣ���С�ͱ�ѹ������Ͳ���������ж���Ӧ�ã�ƫ���ᱵ�����о����Ľṹʾ��ͼ��ͼ��ʾ�����Ļ�ѧʽ�� ������Ti4��������λ��Ϊ ��Ba2��������λ��Ϊ ��

��3�������µ�TiCl4���д̼��Գ�ζ����ɫ��Һ�壬�۵�-23.2�����е�136.2��������TiCl4Ӧ�� ������������ ���塣TiCl4�ڳ�ʪ�������ӷ���ˮ���ð���̣�������Ϊˮ�����________���ɡ�
��4����֪Ti3�����γ���λ��Ϊ6��������ռ乹��Ϊ�������壬����ͼ1��ʾ������ͨ����������ͼ2��ʾ�ķ�������ʾ��ռ乹�ͣ�����A��ʾ���壬M��ʾ����ԭ�ӣ�����λ������[Co(NH3)4Cl2]�Ŀռ乹��ҲΪ�������ͣ����� ��ͬ���칹�壬������ͼ�����н��仭����

����������AC
������1���ģ�IVB��1s22s22p63s23p63d24s2��[Ar]3d24s2
��2��BaTiO3��6��12��
��3�����ۣ����ӣ�HC1��
��4��2��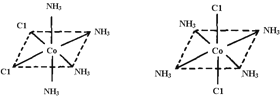
��������
�������������A����ϩ�Ľṹ��ʽΪCH3-CH=CH2��C-C��C-H����Ϊ������C=C��һ��������һ�����������ϩ������8��������1��������A��ȷ��B��SiO2�����У�ÿ��Siԭ���γ�4�����ۼ���1��Oԭ�Ӻ�2��Siԭ���γ�2�����ۼ���B����C��NF3�ķе��NH3�ķе�͵ö࣬����ΪNH3���Ӽ��������NF3���Ӽ�ֻ�з��»�����C��ȷ��D��NCl3��N�γ�3���������µ��Ӷ���=![]() =1��Ϊsp3�ӻ���BCl3��B�γ�3���������µ��Ӷԣ�Ϊsp2�ӻ���D����ѡAC��
=1��Ϊsp3�ӻ���BCl3��B�γ�3���������µ��Ӷԣ�Ϊsp2�ӻ���D����ѡAC��
������1������Ԫ�����ڱ���֪TiԪ��λ��Ԫ�����ڱ��ĵ������ڵ���B�壬TiԪ����22��Ԫ�أ����ݺ�������Ų����ɿ�֪�����Ļ�̬ԭ�ӵĵ��Ӳ��Ų�ʽΪ��1s22s22p63s23p63d24s2��[Ar]3d24s2��
��2����ÿ�������о���һ��Baԭ�ӣ��ĸ�Tiԭ�ӱ��ĸ��������ã�ÿ��������ֻ��һ��Ti��12��Oԭ�Ӿ����ĸ��������ã�ÿ�������к���3��Oԭ�ӣ��ʻ�ѧʽΪBaTiO3��Ti4+������λ��Ϊ![]() =6��Ba2+������λ��Ϊ12��
=6��Ba2+������λ��Ϊ12��
��3�������µ�TiCl4���д̼��Գ�ζ����ɫ��Һ�壬�۵�-23.2�����е�136.2�����۷е�ϵͣ������ɷ����γɣ����ڷ��Ӿ��壬�����ɹ��ۼ��γɣ�TiCl4�ڳ�ʪ�������ӷ���ˮ���ð���̣���HCl���ɣ�
��4��Co3+λ��������������ģ�NH3��Cl-λ���������嶥�㣬������Cl-����ʱΪһ�ֽṹ������Cl-������ʱΪ��һ�ֽṹ���������ֽṹ���� ��
��

 ͬ����ϰ���ϴ�ѧ������ϵ�д�
ͬ����ϰ���ϴ�ѧ������ϵ�д� ͬ����ϰ����ʦ����ѧ������ϵ�д�
ͬ����ϰ����ʦ����ѧ������ϵ�д� ����ϰ�⽭��ϵ�д�
����ϰ�⽭��ϵ�д� ѧ���쳵��������������������ϵ�д�
ѧ���쳵��������������������ϵ�д�����Ŀ����A��B��C��D��E����Ԫ�ء��������Ϣ���£�
Ԫ�� | �����Ϣ |
A | AԪ�ص�һ��ԭ��û�����ӣ�ֻ��һ������ |
B | B�ǵ縺������Ԫ�� |
C | C�Ļ�̬ԭ��2p���������δ�ɶԵ��� |
D | DΪ����Ԫ�أ�����Eͬ���ڣ�����������������˶�״̬��ͬ�ĵ��� |
E | E���γ�ש��ɫ����ɫ����E2O��EO���������� |
�ش��������⡣
��1��д��EԪ��ԭ�ӻ�̬ʱM��ĵ����Ų�ʽ ��
��2��CԪ�ص��ʷ����к������������ļ���֮��Ϊ ��
��3��������ˮ�е��ܽ��C7H15OH���Ҵ��͵�ԭ���ǣ� ��
��4��A��C��E����Ԫ�ؿ��γɣ�E��CA3��42+�����ӣ����д��ڵĻ�ѧ�������� ������ţ���
����λ�� �������� �����Թ��ۼ� ���Ǽ��Թ��ۼ� �����Ӽ� �����
�� E��CA3��42+���жԳƵĿռ乹�ͣ��ҵ� E��CA3��42+�е�����CA3���ӱ�����Clȡ��ʱ���ܵõ����ֲ�ͬ�ṹ�IJ���� E��CA3��42+�Ŀռ乹��Ϊ ������ţ���
a��ƽ�������� b���������� c�������� d��V��
��5�����������ǻ���ɫ��״�ᾧ����ṹ��ͼ��ʾ��

������������Pԭ�Ӳ�ȡ____�ӻ�����PO3����Ϊ�ȵ�����Ļ�������ӵĻ�ѧʽΪ________����NA��ʾ�����ӵ���������ֵ��0��1mol�����������к��еŵ��Ӷ���Ϊ_________��