题目内容
(16分)锰是冶炼工业中常用的添加剂。以碳酸锰矿(主要成分为MnCO3,还含有铁、镍、钴等碳酸盐杂质)为原料生产金属锰的工艺流程如下:
已知25℃,部分物质的溶度积常数如下:
| 物质 | Mn(OH)2 | Co(OH)2 | Ni(OH)2 | MnS | CoS | NiS |
| Ksp | 2.1×10-13 | 3.0×10-16 | 5.0×10-16 | 1.0×10-11 | 5.0×10-22 | 1.0×10-22 |
(2)步骤Ⅱ中,MnO2在酸性条件下可将Fe2+离子氧化为Fe3+,反应的离子方程式是 ,加氨水调节溶液的pH为5.0-6.0,以除去Fe3+。
(3)步骤Ⅲ中,滤渣2的主要成分是 。
(4)步骤Ⅳ中,在 (填“阴”或“阳”)极析出Mn,电极反应方程式为 。
(5)电解后的废水中还含有Mn2+,常用石灰乳进行一级沉降得到Mn(OH)2沉淀,过滤后再向滤液中加入适量Na2S,进行二级沉降。进行二级沉降的目的是 。
(1)MnCO3+H2 SO4 =MnSO4+ CO2↑+H2O (3分)
(2) MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O (3分)
(3) CoS和NiS (3分,错、漏均扣1分)
(4)阴 (1分),Mn2++2e-=Mn (3分)
(5)沉降得到MnS,以进一步去除废水中的Mn2+。 (3分)
解析试题分析:⑴加稀硫酸时样品中的MnCO3和硫酸反应生成可溶性的MnSO4,并产生二氧化碳和水;
⑵据得失电子守恒有MnO2+2Fe2+――Mn2++2Fe3+,再据电荷守恒有MnO2+2Fe2++4H+――Mn2++2Fe3+,最后据原子守恒得MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O;
⑶由于在第一次过滤之后的滤液中含有Mn2+、Ni2+、Co2+,向其中加入(NH4)2S,根据各物质的溶度积常数可确定有CoS和NiS沉淀(滤渣2)生成;
⑷由于第二次过滤后的滤液中主要含有NiSO4,电解该溶液时Ni2+在阴极上被还原:Mn2++2e-=Mn;
⑸由于将一级沉降得到Mn(OH)2沉淀过滤之后的滤液中还含有Mn2+,以进一步去除废水中的Mn2+,向该滤液中加入适量Na2S,进行二级沉降得到MnS[据溶解积常数确定其溶解度比Mn(OH)2小]。
考点:考查化学流程图。

下列实验设计能够成功的是
| | 实验目的 | 实验步骤及现象 |
| A | 检验亚硫酸钠试样是否变质 |  |
| B | 检验某卤代烃是否是氯代烃 |  |
| C | 证明酸性条件H2O2氧化性比I2强 |  |
| D | 除去铁屑表面的油污 | 铁屑用热的碳酸钠溶液洗涤,再用蒸馏水冲洗干净 |
用下列装置进行相应实验,能达到目的的是
| A.用图1装置除去C12中少量的HCl |
| B.用图2装置蒸干NH4Cl饱和溶液制取NH4Cl晶体 |
| C.用图3装置制取纯净的CO2气体 |
| D.用图4装置分离CCl4萃取碘水后的有机层和水层 |
下列有关乙烯和苯燃烧的说法不正确的是
| A.点燃前都要检验纯度 | B.质量相同时,消耗的氧气不同 |
| C.燃烧时都会产生黑烟 | D.充分燃烧,都产生二氧化碳和水 |
乙烯中混有SO2气体,欲除去SO2,得到较纯净的乙烯,最好依次通过下列哪组试剂的洗气瓶( )
| A.酸性KMnO4溶液、浓H2SO4 | B.溴水、浓H2SO4 |
| C.浓H2SO4、酸性KMnO4溶液 | D.NaOH溶液、浓H2SO4 |
(16分)高纯六水氯化锶晶体(SrCl2·6H2O)具有很高的经济价值,工业上用难溶于水的碳酸锶(SrCO3)为原料(含少量钡和铁的化合物等),制备高纯六水氯化锶晶体的过程为:
已知: Ⅰ. SrCl2·6H2O 晶体在61℃时开始失去结晶水,100℃时失去全部结晶水。
Ⅱ.有关氢氧化物开始沉淀和完全沉淀的pH表:
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 |
| 开始沉淀的pH | 1.5 | 6.5 |
| 沉淀完全的pH | 3.7 | 9.7 |
(1)操作①加快反应速率的措施有 (写一种)。
碳酸锶与盐酸反应的离子方程式 。
(2)酸性条件下,加入30% H2O2溶液,将Fe2+氧化成Fe3+,其离子方程式为 。
(3)在步骤②-③的过程中,将溶液的pH值由1调节至4时,宜用的试剂为_______。
A.氨水 B.氢氧化锶粉末 C. 氢氧化钠 D.碳酸钠晶体
(4)操作③中所得滤渣的主要成分是 (填化学式)。
(5)步骤④的操作是 、 。
(6)工业上用热风吹干六水氯化锶,适宜的温度是
A.50~60℃ B.70~80℃ C.80~100℃ D.100℃以上
某研究小组设计如下工艺路线提纯工业碳酸钠。已知工业碳酸钠(纯度约为98%)中含有Ca2+、Mg2+、Fe3+、Cl-、和SO42—等杂质。
Ⅰ.碳酸钠的饱和溶液在不同温度下析出的溶质如下图所示:
Ⅱ.有关物质的溶度积如下:
| 物质 | CaCO3 | MgCO3 | Ca(OH)2 | Mg(OH)2 | Fe(OH)3 |
| Ksp | 4.96×10-9 | 6.82×10-6 | 4.68×10-6 | 5.61×10-12 | 2.64×10-39 |
根据所给信息,回答下列问题:
(1)加入NaOH溶液时发生的离子方程式为___________________________。
向含有Mg2+、Fe3+的溶液中滴加NaOH溶液,当两种沉淀共存且溶液的pH=8时,c(Mg2+)∶c(Fe3+)=__________________________________________
(2)“趁热过滤”时的温度应控制在____________________________________
(3)有人从“绿色化学”的角度设想将“母液”沿流程中虚线所示进行循环使用。请你分析实际工业生产中是否可行__________________,并说明理由_______________________________________
 +2H2O
+2H2O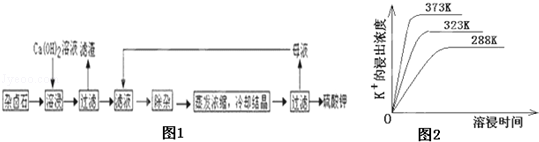
 ?CaCO3(s)+
?CaCO3(s)+
