题目内容
用下列装置进行相应实验,能达到目的的是
| A.用图1装置除去C12中少量的HCl |
| B.用图2装置蒸干NH4Cl饱和溶液制取NH4Cl晶体 |
| C.用图3装置制取纯净的CO2气体 |
| D.用图4装置分离CCl4萃取碘水后的有机层和水层 |
AD
解析试题分析:HCl的溶解度大于NaCl,易溶于饱和食盐水,Cl2的溶解度小于NaCl,难溶于饱和食盐水,故A正确;NH4Cl能水解生成一水合氨和氯化氢,且该反应是吸热反应,蒸干饱和NH4Cl溶液能使其彻底水解,变成氨气、氯化氢、水蒸气,故B错误;Na2CO3+2HCl=2NaCl+CO2↑+H2O,盐酸具有强挥发性,因此只用图3装置制取的气体中含有CO2、HCl、H2O,一定不纯,故C错误;CCl4不溶于水,密度比水大,一定分层,I2微溶于水,易溶于CCl4,CCl4可萃取碘水中的碘单质,下层为碘的CCl4层,上层为水层,故D正确。
考点:考查化学实验基本操作和混合物的分离提纯,涉及洗气装置、蒸发结晶装置、气体发生装置、分液装置等的使用。

下列各组物质的无色溶液,不用其它试剂即可鉴别的是( )
①KOH Na2SO4 AlCl3 ②NaHCO3 Ba(OH)2 H2SO4
③HCI NaAlO2 NaHSO4 ④Ca(OH)2 Na2CO3 BaCl2
| A.①③④ | B.①②④ | C.①② | D.②③ |
用下列实验装置进行相应实验,能达到实验目的的是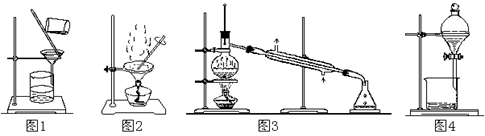
A B C D
| A.用图1 所示装置从Fe(OH)3胶体中过滤出Fe(OH)3胶粒 |
| B.用图2 所示装置蒸发掉CuCl2溶液中部分水制得CuCl2·2H2O晶体 |
| C.用图3 所示装置从CH3OH与C2H5OH的混合物中分离出乙醇 |
| D.用图4 所示装置从C2H5OH与C2H5OOCCH3的混合物中分离出乙酸乙酯 |
下列有关实验装置的说法中正确的是 ( )
| A.用图1可证明SO2与NaOH溶液发生了反应 |
| B.用图2装置不能证明溴乙烷发生消去反应 |
| C.用图3装置制备Fe( OH)2并能较长时间观察其颜色 |
| D.用图4装置测量Cu与浓硝酸反应产生气体的体积 |
适宜用分液漏斗进行分离的一组混合物是( )
| A.乙酸和乙醇 | B.水和氯化钠 | C.水和花生油 | D.四氯化碳和碘 |
下列仪器:①漏斗②容量瓶③蒸馏烧瓶④天平⑤分液漏斗⑥滴定管⑦燃烧匙,常用于物质分离的是( )
| A.①③④ | B.①②⑥ | C.①③⑤ | D.③④⑦ |
(16分)锰是冶炼工业中常用的添加剂。以碳酸锰矿(主要成分为MnCO3,还含有铁、镍、钴等碳酸盐杂质)为原料生产金属锰的工艺流程如下:
已知25℃,部分物质的溶度积常数如下:
| 物质 | Mn(OH)2 | Co(OH)2 | Ni(OH)2 | MnS | CoS | NiS |
| Ksp | 2.1×10-13 | 3.0×10-16 | 5.0×10-16 | 1.0×10-11 | 5.0×10-22 | 1.0×10-22 |
(2)步骤Ⅱ中,MnO2在酸性条件下可将Fe2+离子氧化为Fe3+,反应的离子方程式是 ,加氨水调节溶液的pH为5.0-6.0,以除去Fe3+。
(3)步骤Ⅲ中,滤渣2的主要成分是 。
(4)步骤Ⅳ中,在 (填“阴”或“阳”)极析出Mn,电极反应方程式为 。
(5)电解后的废水中还含有Mn2+,常用石灰乳进行一级沉降得到Mn(OH)2沉淀,过滤后再向滤液中加入适量Na2S,进行二级沉降。进行二级沉降的目的是 。
 白色沉淀
白色沉淀 沉淀不溶解
沉淀不溶解 说明试样已变质
说明试样已变质



 精盐
精盐 溶液颜色无变化
溶液颜色无变化 溶液变红色
溶液变红色
 溶液变蓝色
溶液变蓝色
