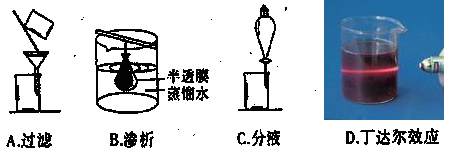
题目内容
下列实验设计能够成功的是
| | 实验目的 | 实验步骤及现象 |
| A | 检验亚硫酸钠试样是否变质 |  |
| B | 检验某卤代烃是否是氯代烃 |  |
| C | 证明酸性条件H2O2氧化性比I2强 |  |
| D | 除去铁屑表面的油污 | 铁屑用热的碳酸钠溶液洗涤,再用蒸馏水冲洗干净 |
D
解析试题分析:A.无法达到实验目的,硝酸可把亚硫酸根离子氧化,错误;B.用硝酸代替硫酸,因为硫酸银也是白色的,错误;C.不应加入HNO3,因为它可以把I-氧化,无法比较H2O2和I2谁的氧化性强,
错误;D.碳酸钠溶液在热的条件下,可以水解为氢氧化钠,油污在氢氧化钠作用下水解,而铁屑和氢氧
化钠不反应。
考点:考查实验设计等相关知识。

练习册系列答案
相关题目
向某无色溶液中分别进行下列操作,所得现象和结论正确的是
| A.加入氨水,产生白色沉淀,证明原溶液中存在Al3+ |
| B.加入AgNO3溶液,产生白色沉淀,证明原溶液中存在Cl- |
| C.加入盐酸酸化的BaCl2溶液,生成白色沉淀,证明原溶液中存在SO42- |
| D.加入NaOH溶液并加热,产生使湿润的红色石蕊试纸变蓝的气体,证明原溶液中存在NH4+ |
下列各组物质的无色溶液,不用其它试剂即可鉴别的是( )
①KOH Na2SO4 AlCl3 ②NaHCO3 Ba(OH)2 H2SO4
③HCI NaAlO2 NaHSO4 ④Ca(OH)2 Na2CO3 BaCl2
| A.①③④ | B.①②④ | C.①② | D.②③ |
下列对检验方法或现象描述错误的是
| A.苯中是否混有苯酚,可用加溴水是否产生白色沉淀进行检验 |
| B.乙醛中是否混有乙醇,可用加入金属钠是否产生气体进行检验 |
| C.乙醇中是否混有水,可用加硫酸铜粉末是否变蓝进行检验 |
| D.乙酸乙酯是否混有乙酸,可用加石蕊试液是否变红进行检验 |
水杨酸甲酯(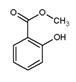 )具有冬青味,故又名冬青油,主要用于制造杀虫剂、杀菌剂、香料、涂料等。用水杨酸(
)具有冬青味,故又名冬青油,主要用于制造杀虫剂、杀菌剂、香料、涂料等。用水杨酸(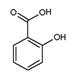 )与甲醇酯化而得的冬青油中往往会混有未反应完全的水杨酸,若要进行提纯,适宜的洗涤剂为( )
)与甲醇酯化而得的冬青油中往往会混有未反应完全的水杨酸,若要进行提纯,适宜的洗涤剂为( )
| A.NaHCO3溶液 | B.NaOH溶液 | C.Na2CO3溶液 | D.NaCl溶液 |
用下列实验装置进行相应实验,能达到实验目的的是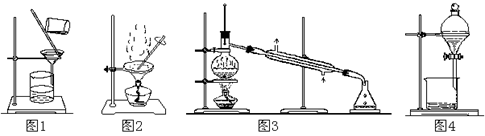
A B C D
| A.用图1 所示装置从Fe(OH)3胶体中过滤出Fe(OH)3胶粒 |
| B.用图2 所示装置蒸发掉CuCl2溶液中部分水制得CuCl2·2H2O晶体 |
| C.用图3 所示装置从CH3OH与C2H5OH的混合物中分离出乙醇 |
| D.用图4 所示装置从C2H5OH与C2H5OOCCH3的混合物中分离出乙酸乙酯 |
下列有关实验装置的说法中正确的是 ( )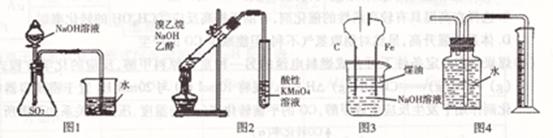
| A.用图1可证明SO2与NaOH溶液发生了反应 |
| B.用图2装置不能证明溴乙烷发生消去反应 |
| C.用图3装置制备Fe( OH)2并能较长时间观察其颜色 |
| D.用图4装置测量Cu与浓硝酸反应产生气体的体积 |
(16分)锰是冶炼工业中常用的添加剂。以碳酸锰矿(主要成分为MnCO3,还含有铁、镍、钴等碳酸盐杂质)为原料生产金属锰的工艺流程如下: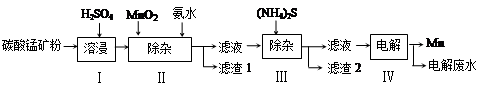
已知25℃,部分物质的溶度积常数如下:
| 物质 | Mn(OH)2 | Co(OH)2 | Ni(OH)2 | MnS | CoS | NiS |
| Ksp | 2.1×10-13 | 3.0×10-16 | 5.0×10-16 | 1.0×10-11 | 5.0×10-22 | 1.0×10-22 |
(2)步骤Ⅱ中,MnO2在酸性条件下可将Fe2+离子氧化为Fe3+,反应的离子方程式是 ,加氨水调节溶液的pH为5.0-6.0,以除去Fe3+。
(3)步骤Ⅲ中,滤渣2的主要成分是 。
(4)步骤Ⅳ中,在 (填“阴”或“阳”)极析出Mn,电极反应方程式为 。
(5)电解后的废水中还含有Mn2+,常用石灰乳进行一级沉降得到Mn(OH)2沉淀,过滤后再向滤液中加入适量Na2S,进行二级沉降。进行二级沉降的目的是 。