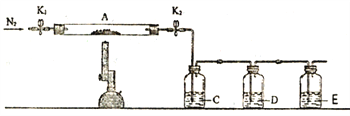
题目内容
【题目】铬铁矿的主要成分可表示为FeO·Cr2O3,还含有MgO、Al2O3、Fe2O3等杂质,以下是以铬铁矿为原料制备重铬酸钾(K2Cr2O7)的流程图:
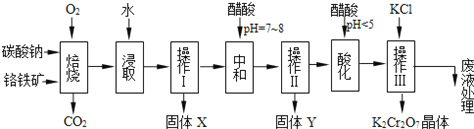
已知:Na2CO3+Al2O3![]() 2NaAlO2+CO2↑;
2NaAlO2+CO2↑;
4FeO·Cr2O3+8Na2CO3+7O2![]() 8Na2CrO4+2Fe2O3+8CO2↑。
8Na2CrO4+2Fe2O3+8CO2↑。
回答下列问题:
(1)固体X中主要含有________________(填写化学式)。
(2)固体Y中主要含有氢氧化铝,请写出调节溶液的pH=7~8时生成氢氧化铝的离子方程式:____________________________________________________________。
(3)酸化的目的是使CrO42转化为Cr2O72,若将醋酸改用稀硫酸,写出该转化的离子方程式:___________________________________________________________。
(4)操作Ⅲ有多步组成,获得K2Cr2O7晶体的操作依次是:加入KCl固体、蒸发浓缩、__________、过滤、_______、干燥。
(5)酸性溶液中过氧化氢能使Cr2O72生成蓝色的过氧化铬(CrO5分子结构为![]() ),该反应可用来检验Cr2O72的存在。写出反应的离子方程式:___________________________,该反应_________(填“属于”或“不属于”)氧化还原反应。
),该反应可用来检验Cr2O72的存在。写出反应的离子方程式:___________________________,该反应_________(填“属于”或“不属于”)氧化还原反应。
(6)在化学分析中采用K2CrO4为指示剂,以AgNO3标准溶液滴定溶液中的Cl,利用Ag+与CrO42生成砖红色沉淀,指示到达滴定终点。当溶液中Cl恰好完全沉淀(浓度等于1.0×105 mol·L1)时,溶液中c(Ag+)为_______mol·L1,此时溶液中c(CrO42)等于_________mol·L1。(已知Ag2CrO4、AgCl的Ksp分别为2.0×1012和2.0×1010)。
【答案】 Fe2O3、MgO CH3COOH+AlO2+H2O=Al(OH)3↓+CH3COO 2CrO42+2H+=Cr2O72+H2O 冷却结晶 洗涤 Cr2O72+4H2O2+2H+=2CrO5+5H2O 不属于 2.0×105 5.0×103
【解析】试题分析:由题中信息可知,铬铁矿与碳酸钠一起焙烧时,其主要成分和氧化铝可与碳酸钠等发生反应转化为铬酸钠、偏铝酸钠、氧化铁,反应混合物经水浸后过滤,除去不溶物氧化铁、氧化镁等;滤液经醋酸调pH至7~8,偏铝酸钠转化为氢氧化铝沉淀,过滤除去氢氧化铝;再向滤液中加醋酸调pH至小于5,铬酸钠转化为重铬酸钠;加入氯化钾与重铬酸钠发生复分解反应生成重铬酸钾,分离提纯得到重铬酸钾晶体。
(1)固体X中主要含有Fe2O3、MgO。
(2)固体Y中主要含有氢氧化铝,调节溶液的pH=7~8时生成氢氧化铝的离子方程式为CH3COOH+AlO2+H2O=Al(OH)3↓+CH3COO。
(3)酸化的目的是使CrO42转化为Cr2O72,若将醋酸改用稀硫酸,该转化的离子方程式为2CrO42+2H+=Cr2O72+H2O。
(4)操作Ⅲ有多步组成,获得K2Cr2O7晶体的操作依次是:加入KCl固体、蒸发浓缩、冷却结晶、过滤、洗涤、干燥。
(5)酸性溶液中过氧化氢能使Cr2O72生成蓝色的过氧化铬(CrO5分子结构为![]() ),该反应可用来检验Cr2O72的存在。反应的离子方程式为Cr2O72+4H2O2+2H+=2CrO5+5H2O,由CrO5的结构式可知,其中Cr的化合价为+6,该反应中没有任何一种元素的化合价发生变化,故该反应不属于氧化还原反应。
),该反应可用来检验Cr2O72的存在。反应的离子方程式为Cr2O72+4H2O2+2H+=2CrO5+5H2O,由CrO5的结构式可知,其中Cr的化合价为+6,该反应中没有任何一种元素的化合价发生变化,故该反应不属于氧化还原反应。
(6)在化学分析中采用K2CrO4为指示剂,以AgNO3标准溶液滴定溶液中的Cl,利用Ag+与CrO42生成砖红色沉淀,指示到达滴定终点。当溶液中Cl恰好完全沉淀(浓度等于1.0×105 mol·L1)时,溶液中c(Ag+)为![]() 2.0×105mol·L1,此时溶液中c(CrO42)等于
2.0×105mol·L1,此时溶液中c(CrO42)等于 =5.0×103mol·L1。
=5.0×103mol·L1。

 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案【题目】党的十九大报告提出“加快生态文明体制改革,建设美丽中国”,发展清洁能源对建设美丽中国具有重要意义。氢能是一种高效清洁、极具发展潜力的能源。
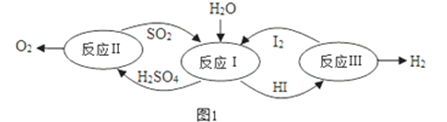
(1)以太阳能为热源,热化学硫碘循环分解水是一种高效、无污染的制氢方法。其反应过程如图1所示:
①反应Ⅰ的离子方程式是______________________________________________;反应Ⅰ得到的产物用I2进行分离,该产物的溶液在过量I2的存在下会分成两层:含低浓度I2的H2SO4层和含高浓度I2的HI层。经离子浓度检测,H2SO4溶液层中c(H+):c(SO42-)=2.06:1,其比值大于2的原因是 _______________________ 。
②反应Ⅱ:2H2SO4(l)=2SO2(g)+O2(g)+ 2H2O(g)△H = +550kJmo1-1,它由两步反应组成:ⅰ.H2SO4(l)=SO3(g)+ H2O(g)△H = +177kJmo1-1,ⅱ.SO3(g)分解,写出SO3(g)分解的热化学方程式 ______________________________。
(2)工业上利用反应C(s)+2H2O(g)![]() CO2(g)+2H2(g) △H>0 也可制备氢气。一定条件下,将C(s)和H2O(g)分别加入甲、乙两个密闭容器发生反应,其相关数据如表所示:
CO2(g)+2H2(g) △H>0 也可制备氢气。一定条件下,将C(s)和H2O(g)分别加入甲、乙两个密闭容器发生反应,其相关数据如表所示:
容器 | 容积/L | 温度/℃ | 起始量/mol | 平衡量/mol | |
C(s) | H2O(g) | H2(g) | |||
甲 | 2 | T1 | 2 | 4 | 3.2 |
乙 | 1 | T2 | 1 | 2 | 1.2 |
①T1℃时,该反应的平衡常数K= ______ ;T1 ______ T2(填“>”、“=”或“<”);
②若乙容器中达到平衡所需时间为3min,则当反应进行到1.5min时,H2O(g)的物质的量浓度 ______(填选项字母)。
A.=1.4mol/L B.<1.4mol/L C.>1.4mol/L
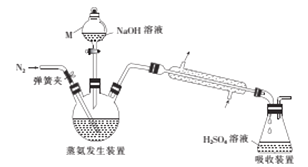
(3)工业上还可采用电化学法利用H2S废气制取氢气,该法制氢过程的示意图如图所示,
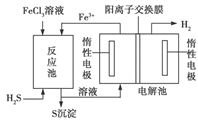
①反应池中反应物的流向采用气、液逆流方式,其目的是____________________;
②反应池中发生反应后的溶液进入电解池,电解总反应的离子方程式为_____________。