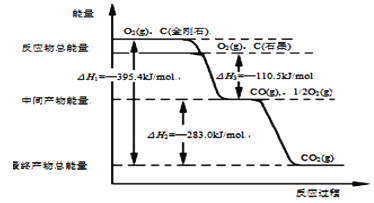
题目内容
【题目】某兴趣小组用如图所示装置进行实验,探究铁和浓硫酸反应的产物及性质。(夹持装置已略,气密性已检验)
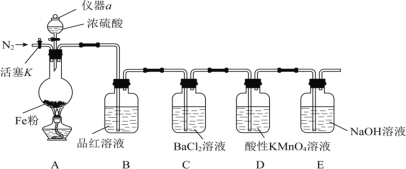
实验开始前,先打开活塞K通一段时间N2。关闭活塞K后,向A中滴加一定量的浓硫酸,加热观察到A中铁片上有气泡产生。
请回答下列问题:
(1)仪器a的名称是___。实验开始前,先通一段时间N2的目的是___。
(2)加热一段时间后发现B装置中溶液褪色,说明有__(填化学式)生成。再取出A中反应后的溶液少许,加入KSCN溶液未出现血红色,浓硫酸与铁反应的化学方程式是__。
(3)C装置中__(填“有”或“无”)沉淀生成。D装置中溶液紫色褪去,该反应的离子方程式为__。
(4)E装置的作用是__。(用离子方程式表示)
【答案】分液漏斗 排除装置中的空气(防止氧气对SO2的性质的检验产生干扰) SO2 Fe+2H2SO4(浓)![]() FeSO4+SO2↑+2H2O 无 5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+ SO2+2OH-=SO32-+H2O(或SO2+OH-=HSO3-)
FeSO4+SO2↑+2H2O 无 5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+ SO2+2OH-=SO32-+H2O(或SO2+OH-=HSO3-)
【解析】
实验开始前,先打开弹簧夹通一段时间N2,先排出装置中的空气,A中滴加一定量的浓硫酸,加热,取出A中的溶液少许,加入KSCN溶液未出现血红色,A中发生Fe+2H2SO4(浓)![]() FeSO4+SO2↑+2H2O,B中品红可检验二氧化硫的生成,C中二氧化硫与氯化钡不反应,D中二氧化硫与酸性高锰酸钾发生氧化还原反应使溶液褪色,E为尾气处理吸收过量的二氧化硫,以此来解答。
FeSO4+SO2↑+2H2O,B中品红可检验二氧化硫的生成,C中二氧化硫与氯化钡不反应,D中二氧化硫与酸性高锰酸钾发生氧化还原反应使溶液褪色,E为尾气处理吸收过量的二氧化硫,以此来解答。
(1)仪器a的名称是分液漏斗;实验开始前,先通一段时间N2的目的是排除装置中的空气(防止氧气对SO2的性质的检验产生干扰)。故答案为:分液漏斗;排除装置中的空气(防止氧气对SO2的性质的检验产生干扰);
(2)二氧化硫具有漂白性,可使品红溶液褪色,加热一段时间后发现B装置中溶液褪色,说明有SO2生成。再取出A中反应后的溶液少许,加入KSCN溶液未出现血红色,说明无三价铁离子生成,浓硫酸与铁反应的化学方程式是Fe+2H2SO4(浓)![]() FeSO4+SO2↑+2H2O。故答案为:SO2;Fe+2H2SO4(浓)
FeSO4+SO2↑+2H2O。故答案为:SO2;Fe+2H2SO4(浓)![]() FeSO4+SO2↑+2H2O;
FeSO4+SO2↑+2H2O;
(3)盐酸的酸性强于亚硫酸,二氧化硫与氯化钡溶液不反应,C装置中无沉淀生成。酸性高锰酸钾具有强氧化性,通入二氧化硫溶液褪色,说明二氧化硫将高锰酸钾还原,D装置中溶液紫色褪去,该反应的离子方程式为5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+。故答案为:无;5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+;
(4)E装置的作用是尾气处理,防止污染空气,离子方程式为:SO2+2OH-=SO32-+H2O(或SO2+OH-=HSO3-);故答案为:SO2+2OH-=SO32-+H2O(或SO2+OH-=HSO3-)。

 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案