题目内容
【题目】已知A、B为常见的浓酸溶液;X、Y、Z、W均为氧化物,其中X是红棕色气体,Y的固体可用于人工降雨,W既能使澄清石灰水变浑浊,又能使品红溶液褪色。根据如图所示转化关系(反应条件略),回答下列问题:
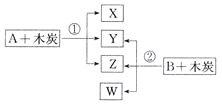
(1)Y是__________(填化学式)。
(2)将B露置在空气中一段时间,溶液质量增加但溶液浓度降低,表明B具有_____性;利用这种性质可以进行______(填字母)实验操作。
![]() 干燥二氧化硫
干燥二氧化硫 ![]() 检验
检验![]() c 干燥氨气
c 干燥氨气 ![]() 钝化铝片
钝化铝片
(3)写出X与Z的反应方程式:________________。
(4)W具有漂白性,氯水也有漂白性,两者同时使用,漂白效果将_________(填“增强”或“减弱”),原因是____________(用化学方程式表示)。
(5)反应①中氧化产物和还原产物的物质的量之比为____。
【答案】CO2 吸水 a 3NO2+H2O=2HNO3+NO 减弱 SO2+Cl2+2H2O=H2SO4+2HCl 1:4
【解析】
X是红棕色气体,应为NO2,Y的固体可用于人工降雨,应为CO2,则A为浓硝酸,Z为H2O,W既能使澄清石灰水变浑浊,又能使品红溶液褪色,应为SO2,由转化关系可知B为浓硫酸,以此解答该题。
(1)由以上分析可知Y为CO2;
(2)将浓硫酸露置在空气中一段时间,溶液质量增加但溶液浓度降低,表明浓硫酸具有吸水性,利用这种性质可用于干燥气体,但不能干燥碱性气体,故答案选a;
(3)二氧化氮与水反应生成硝酸和NO,反应的方程式为3NO2+H2O=2HNO3+NO;
(4)氯气和二氧化硫发生氧化还原反应生成盐酸和硫酸,方程式为反应方程式为:SO2+Cl2+2H2O=H2SO4+2HCl,导致漂白效果减弱;
(5)反应①为C+4HNO3(浓)![]() CO2↑+4NO2↑+2H2O,由方程式可知氧化产物和还原产物的物质的量之比为1:4。
CO2↑+4NO2↑+2H2O,由方程式可知氧化产物和还原产物的物质的量之比为1:4。

【题目】某溶液中含有以下离子中的若干种:K+、Cl-、NH、Mg2+、CO![]() 、Ba2+、SO
、Ba2+、SO![]() 。现取3份该溶液各100 mL分别进行如下实验:
。现取3份该溶液各100 mL分别进行如下实验:
实验序号 | 实验内容 | 实验结果 |
① | 加AgNO3溶液 | 有白色沉淀生成 |
② | 加足量NaOH溶液并加热 | 收集到气体,在标准状况下体积为2.24 L |
③ | 加足量BaCl2溶液,对所得沉淀进行洗涤、干燥、称量;再向沉淀中加足量稀盐酸,然后干燥、称量 | 第一次称量读数为12.54 g,第二次称量读数为4.66g |
试回答下列问题:
(1)根据实验①对Cl-是否存在的判断是_______________(填“一定存在”“一定不存在”或“不能确定”);根据实验①~③判断混合物中一定不存在的离子是___________。
(2)试确定溶液中一定存在的阴离子及其物质的量浓度(可不填满):
阴离子符号 | 物质的量浓度(mol/L) |
__________ | |
(3)试确定K+是否存在 __________ (填“是”或“否”),判断的理是______________________。