题目内容
【题目】常温下,![]() 的三种盐溶液
的三种盐溶液![]() 的pH分别为7、8、9,则下列比较中正确的是( )
的pH分别为7、8、9,则下列比较中正确的是( )
A.![]() 的酸性依次增强
的酸性依次增强
B.溶液中的离子浓度![]()
C.电离常数![]() ,水解常数
,水解常数![]()
D.![]()
【答案】D
【解析】
常温下,0.1mol/L的三种盐溶液NaX.NaY.NaZ的pH分别为7、8、9,对于弱酸,其酸性越弱,对应的盐水解程度越大,说明HX为强酸,HY、XZ为弱酸,且酸性HY>XZ,由此分析解答.
A、对于弱酸,其酸性越弱,对应的盐水解程度越大,说明HX为强酸,HY、XZ为弱酸,且酸性HX>HY>XZ,故A错误;
B、酸越弱水解的程度越大,离子浓度越小,所以c(X-)>c(Y-)>c(Z-),故B错误;
C、对于弱酸,其酸性越弱,对应的盐水解程度越大,说明HX为强酸,HY、XZ为弱酸,且酸性HX>HY>XZ,电离常数K(HY)>K(HZ),酸性越弱,对应的盐水解程度越大,水解常数K(Y-)<K(Z-),故C错误;
D、NaX电离后不水解,X-的物质的量浓度c(X-)=0.1mol/L,NaY、NaZ电离后都部分水解,根据物料守恒可知:c(Y-)+c(HY)=0.1mol/L;c(Z-)+c(HZ)=0.1mol/L,所以c(X-)=c(Y-)+c(HY)=c(Z-)+c(HZ),故D正确;
故答案为:D。

【题目】目前全世界的镍(Ni)消费量仅次于铜、铝、铅、锌,居有色金属第五位。镍常用于各种高光泽装饰漆和塑料生产,也常用作催化剂。
碱式碳酸镍的制备:
工业用电解镍新液(主要含NiSO4,NiCl2等)制备碱式碳酸镍晶体[xNiCO3·yNi(OH)2·zH2O],制备流程如图:
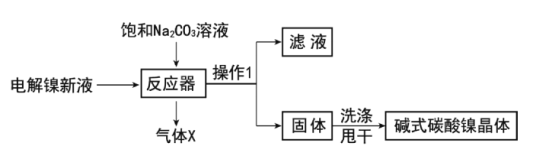
(1)反应器中的一个重要反应为3NiSO4+3Na2CO3+2H2O=NiCO3·2Ni(OH)2+3Na2SO4+2X,X的化学式为__。
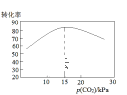
(2)物料在反应器中反应时需要控制反应温度和pH值。分析如图,反应器中最适合的pH值为__。
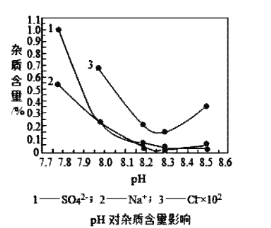
(3)检验碱式碳酸镍晶体洗涤干净的方法是__。
测定碱式碳酸镍晶体的组成:
为测定碱式碳酸镍晶体[xNiCO3·yNi(OH)2·zH2O]组成,某小组设计了如图实验方案及装置:
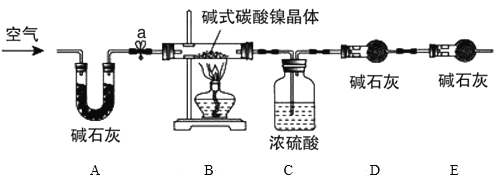
资料卡片:碱式碳酸镍晶体受热会完全分解生成NiO、CO2和H2O
实验步骤:
①检查装置气密性;
②准确称量3.77g碱式碳酸镍晶体[xNiCO3·yNi(OH)2·zH2O]放在B装置中,连接仪器;
③打开弹簧夹a,鼓入一段时间空气,分别称量装置C、D、E的质量并记录;
④__;
⑤打开弹簧夹a缓缓鼓入一段时间空气;
⑥分别准确称量装置C、D、E的质量并记录;
⑦根据数据进行计算(相关数据如下表)
装置C/g | 装置D/g | 装置E/g | |
加热前 | 250.00 | 190.00 | 190.00 |
加热后 | 251.08 | 190.44 | 190.00 |
实验分析及数据处理:
(4)E装置的作用__。
(5)补充④的实验操作___。
(6)通过计算得到碱式碳酸镍晶体的组成__(填化学式)。
镍的制备:
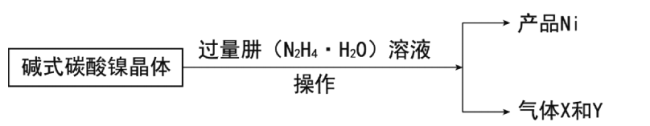
(7)写出制备Ni的化学方程式__。