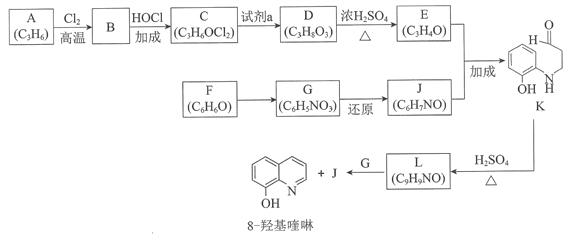
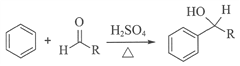
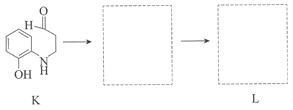
题目内容
【题目】下列各组离子中,每个离子都能影响水的电离平衡的是( )
A.![]()
B.![]()
C.![]()
D.![]()
【答案】C
【解析】
影响因素有温度、酸、碱、盐等,加热促进电离;加酸、加碱抑制水的电离;能水解的盐促进水的电离,结合离子的性质解答该题。
A.Cl-,SO42-为强酸的阴离子,不能结合水电离的氢离子生成弱电解质,不能影响水的电离,故A错误;
B.Br-为强酸的阴离子,不能结合水电离的氢离子生成弱电解质,不能影响水的电离,故B错误;
C.Ag+、Fe2+为弱碱阳离子,SO32-、SiO32-、S2-为弱酸的阴离子,都能与水电离出的氢离子或氢氧根离子结合成弱电解质,能促进水的电离,故C正确;
D.NO3-为强酸的阴离子,不能结合水电离的氢离子生成弱电解质,不能影响水的电离,故D错误。
故答案为D。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
【题目】在一定温度下,10mL0.40mol/L H2O2发生催化分解。不同时刻测定生成O2的体积(已折算为标准状况)如下表。
t/min | 0 | 2 | 4 | 6 | 8 | 10 |
V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
下列叙述不正确的是(溶液体积变化忽略不计)
A.0~6min的平均反应速率:v(H2O2)![]()
![]() mol/(L·min)
mol/(L·min)
B.6~10min的平均反应速率:v(H2O2)<![]() mol/(L·min)
mol/(L·min)
C.反应至6min时,c(H2O2)=0.3mol/L
D.反应至6min时,H2O2分解了50%