题目内容
【题目】在2L带气压计的恒容密闭容器中通入2molX(g)和1molY(g),发生反应:2X(g)+Y(g)![]() 2Z(g);△H<0。若达到平衡时气体总物质的量变为原来的0.85倍。请回答下列问题。
2Z(g);△H<0。若达到平衡时气体总物质的量变为原来的0.85倍。请回答下列问题。
(1)若反应经历5min达到平衡,则Y的平均反应速率为___。
(2)相同条件下进行反应,在t1时刻,只改变下列某一种条件,其曲线图象如图甲。
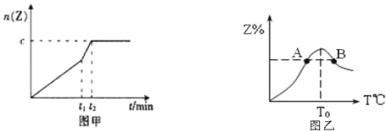
若c=0.90mol,t1时刻改变的条件是___(填选项编号,A.升温B.降温C.加压D.减压E.加催化剂),t2___5min(填“>”,“<”或“=”下同)。
(3)若其他条件不变,原容器为恒压容器,达到平衡后Z的物质的量___0.9mol(填“>”,“<”或“=”)。
(4)若将物质的量均为3.00mol物质X、Y混合于5L容器中发生反应,在反应过程中Z的物质的量分数随温度变化如图乙。
①A、B两点Z物质正反应速率的大小关系是___;
②温度T<T0时,Z%逐渐增大的原因是___。
【答案】0.045mol/(Lmin) E < > B>A 反应还没有到达平衡,反应向正反应进行,随着温度升高,生成的Z越来越多,故Z%逐渐增大
【解析】
(1)根据三段式利用v=△c÷△t计算;
(2)根据外界条件对反应速率和平衡状态的影响分析;
(3)根据压强对平衡状态的影响判断;
(4)根据温度对反应速率和平衡状态的影响结合图像分析。
(1)设平衡时消耗Y的物质的量为x mol,则根据方程式可知
2X(g)+Y(g)![]() 2Z(g)
2Z(g)
起始量(mol) 2 1 0
转化量(mol) 2x x 2x
平衡量(mol)2-2x 1-x 2x
若达到平衡时气体总物质的量变为原来的0.85倍,则2-2x+1-x+2x=3×0.85,解得x=0.45,所以若反应经历5min达到平衡,则Y的平均反应速率=0.45mol÷(2L×5min)=0.045mol/(Lmin);
(2)根据(1)中分析可知原平衡时Z的物质的量是0.90mol,若c=0.90mol,图像分析可知t1时刻曲线斜率变大,说明反应速率增大,但平衡时Z的物质的量不变,说明平衡不移动,因此改变的条件是加入了催化剂,答案选E;由于t1时刻反应速率增大,所以达到平衡所需要的时间缩短,t2小于5min;
(3)若其他条件不变,原容器为恒压容器,恒压容器中反应是气体体积减小的反应,为保持恒压体积缩小相当于在恒容的基础上加压,平衡正向进行,Z的物质的量增大,达到平衡后Z的物质的量大于0.9mol;
(4)①起始时加入物质的量均为3.00mol的物质X、Y,随着温度的升高,反应向正反应方向进行,当温度达到T0时,Z的物质的量分数最大,说明达到反应的最大限度,即平衡状态,此时正逆反应速率相等,随着温度的继续升高,Z的物质的量分数逐渐减小,说明温度升高平衡左移,则正反应为放热反应,温度越高,反应速率越大,B点温度大于A点,则A点反应速率小于B点;
②温度T<T0时,Z%逐渐增大的原因是,温度T0前,反应还没有到达平衡,反应向正反应方向进行,随着温度升高,生成的Z越来越多,因此Z%逐渐增大。