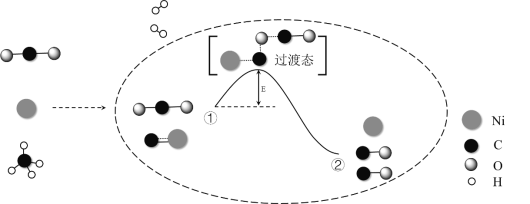
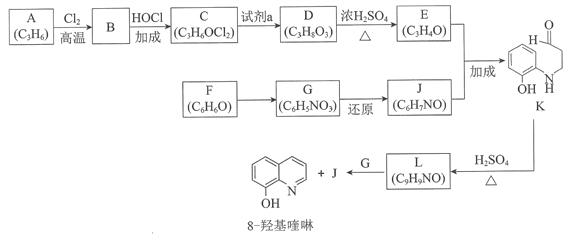
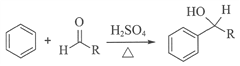
题目内容
【题目】按要求回答下列问题。
(1)![]() 可溶解在
可溶解在![]() 溶液中的原因是____________________________________________________。
溶液中的原因是____________________________________________________。
(2)直接蒸发![]() 溶液,能不能得到
溶液,能不能得到![]() 晶体,其正确的操作__________________________。
晶体,其正确的操作__________________________。
(3)在![]() 溶液中滴加酚酞,溶液变红色,若在该溶液中滴入过量的
溶液中滴加酚酞,溶液变红色,若在该溶液中滴入过量的![]() 溶液,现象是_________________________________________________,请结合离子方程式,运用平衡原理进行解释:________________________________________________________________________。
溶液,现象是_________________________________________________,请结合离子方程式,运用平衡原理进行解释:________________________________________________________________________。
【答案】在![]() 溶液中存在
溶液中存在![]() ,加入Mg粉,Mg与
,加入Mg粉,Mg与![]() 反应放出
反应放出![]() ,使溶液中
,使溶液中![]() 降低,水解平衡向右移动,使Mg粉不断溶解 不能,应在
降低,水解平衡向右移动,使Mg粉不断溶解 不能,应在![]() 气流中加热蒸发 产生白色沉淀,且红色褪去 在
气流中加热蒸发 产生白色沉淀,且红色褪去 在![]() 溶液中,
溶液中,![]() 水解:
水解:![]() ,加入
,加入![]() 后,
后,![]() (白色),由于
(白色),由于![]() 减小,
减小,![]() 水解平衡左移,
水解平衡左移,![]() 减小,红色褪去
减小,红色褪去
【解析】
(1)氯化铵水解显酸性,Mg会与氢离子发生反应,故答案为:在![]() 溶液中存在
溶液中存在![]() ,加入Mg粉,Mg与
,加入Mg粉,Mg与![]() 反应放出
反应放出![]() ,使溶液中
,使溶液中![]() 降低,水解平衡向右移动,使Mg粉不断溶解;
降低,水解平衡向右移动,使Mg粉不断溶解;
(2)氯化铜溶液中存在铜离子的水解![]() ,故答案为:不能,应在
,故答案为:不能,应在![]() 气流中加热蒸发;
气流中加热蒸发;
(3)在![]() 溶液中,
溶液中,![]() 水解:
水解:![]() ,加入
,加入![]() 后
后![]() (白色),由于
(白色),由于![]() 减小,
减小,![]() 水解平衡左移,
水解平衡左移,![]() 减小,红色褪去;故答案为:红色褪去,生成白色沉淀;在
减小,红色褪去;故答案为:红色褪去,生成白色沉淀;在![]() 溶液中,
溶液中,![]() 水解:
水解:![]() ,加入
,加入![]() 后,
后,![]() (白色),由于
(白色),由于![]() 减小,
减小,![]() 水解平衡左移,
水解平衡左移,![]() 减小,红色褪去。
减小,红色褪去。

【题目】绿水青山就是金山銀山,生产生活中污染物的合理处理对环境保护具有重要意义。
(1)利用某些催化剂,成功实现将空气中的碳氧化合物和氮氧化合物转化为无毒的大气循环物质。
已知:①![]()
![]()
②NO(g)+CO(g)![]()
![]() N2(g)+CO2(g)
N2(g)+CO2(g)![]()
③2NO(g)+O2(g)![]() 2NO2(g)
2NO2(g) ![]()
反应![]() 的
的![]() ________
________![]() ;某温度下,反应①②③的平衡常数分別カ
;某温度下,反应①②③的平衡常数分別カ![]() 、
、![]() 、
、![]() ,则该反应的K=________(用
,则该反应的K=________(用![]() 、
、![]() 、
、![]() 表示)。
表示)。
(2)温度为![]() ℃吋,在四个容积均为1L的恒容密闭容器中发生反应:
℃吋,在四个容积均为1L的恒容密闭容器中发生反应:
![]()
![]() ,测得有关实验数据如下:
,测得有关实验数据如下:
容器编号 | 物质的起始浓度( | 物质的平衡浓度( | |
|
|
| |
Ⅰ |
|
|
|
Ⅱ |
|
| |
Ⅲ |
|
| |
Ⅳ |
|
| |
①平衡时,容器Ⅱ与Ⅳ容器的总压强之比___________。
②温度不变,容器Ⅲ中达到平衡后再充入NO、![]() (g)各
(g)各![]() mol,则反应将向_____________。(填“正”或“逆”)方向进行。
mol,则反应将向_____________。(填“正”或“逆”)方向进行。
(3)常温下用0.100![]() 盐酸分别滴定10.00mL浓度均为0.100
盐酸分别滴定10.00mL浓度均为0.100![]() 的NaOH溶液和二甲胺[
的NaOH溶液和二甲胺[![]() ]溶液(在水中电离方式与氨相似),利电用传感器测得滴定过程中溶液的电导率如图所示。已知电解质溶液电导率越大导电能力越强。
]溶液(在水中电离方式与氨相似),利电用传感器测得滴定过程中溶液的电导率如图所示。已知电解质溶液电导率越大导电能力越强。

①a、b、c、d四点的水溶液中,由水电离出氢离子浓度大于![]()
![]() 的是________________,原因为_____________________。
的是________________,原因为_____________________。
②化学反应往往伴有热效应若为绝热体系a的温度______________(填“>”,“=”或“<”)c点的温度。