题目内容
【题目】CuSO4是一种重要的化工原料,其有关制备途径及性质如图所示。下列说法不正确的是
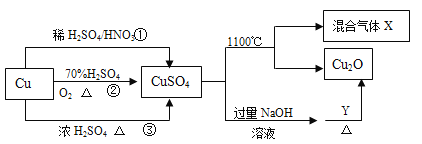
A. Y可以是葡萄糖
B. 途径①所用混酸中H2SO4与HNO3物质的量之比最好为3∶2
C. 相对于途径①、③,途径②更好地体现了绿色化学思想
D. 1 mol CuSO4在1100 ℃所得混合气体X中O2为0.75 mol
【答案】D
【解析】
A、向CuSO4溶液中加入过量的NaOH溶液生成Cu(OH)2悬浊液,再加入含有醛基的物质,如葡萄糖、醛类等,并加热煮沸,就会发生氧化还原反应生成砖红色的Cu2O沉淀,因此Y可以是葡萄糖,A正确;
B、途径①反应的实质为3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,产生2mol的NO消耗2mol硝酸,则同时提供2mol的H+,所以8mol的H+中硫酸提供6mol,这样消耗硫酸最少,为3mol,混酸中H2SO4与HNO3物质的量之比最好为3∶2,B正确;
C、途径②2Cu+O2![]() 2CuO,CuO+H2SO4=CuSO4+H2O,没有生成有毒气体,而铜与浓硫酸或硝酸反应都会生成有毒气体,因此相对于途径①、③,途径②更好地体现了绿色化学思想,C正确;
2CuO,CuO+H2SO4=CuSO4+H2O,没有生成有毒气体,而铜与浓硫酸或硝酸反应都会生成有毒气体,因此相对于途径①、③,途径②更好地体现了绿色化学思想,C正确;
D、X为SO3、SO2和O2的混合物,发生2CuSO4![]() Cu2O+SO2↑+SO3↑+O2↑,由方程式可知1 mol CuSO4在1100℃所得混合气体X中O2为0.5 mol,D错误。
Cu2O+SO2↑+SO3↑+O2↑,由方程式可知1 mol CuSO4在1100℃所得混合气体X中O2为0.5 mol,D错误。
答案选D。

练习册系列答案
相关题目