题目内容
【题目】云阳龙缸云端廊桥曾被詟为“世界第一悬挑玻璃景观廊桥”,所用钢化玻璃因其优良的性能广泛应用于日常生活,但由于制作玻璃时里面含有极少量硫化镍,使得钢化玻璃在极限条件下的使用受到限制.
(1)基态硫原子价层电子的轨道表达式(电子排布图)为_____________________
(2)Ni(CO)4常用于制备纯镍,溶于乙醇、CCl4、苯等有机溶剂,为___________晶体,Ni(CO)4
空间构型与甲烷相同,中心原子的杂化轨道类型为___________,写出与配体互为等电子体的阴离子________________________(任写一种).
(3)黄血盐[K4Fe(CN)63H2O]中,三种同周期非金属元素第一电离能由小到大顺序为_________________。
(4)与硫同族的硒元素有两种常见的二元含氧酸,请比较它们酸性强弱 > (填化学式),_________,理由是________________________________________________________.
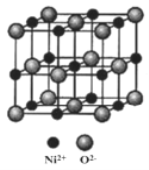
(5)NiO与NaCl的晶胞结构相似,如图所示,阴离子采取面心立方堆积,阳离子填充在位于阴离子构成的空隙中,已知Ni2+半径为69nm,O2-半径为140nm,阿伏伽德罗常数为NA,NiO晶体的密度为________________g/cm3(只列出计算式).
【答案】![]() 分子晶体sp3杂化CN- 或C22-C <O< NH2SeO4>H2SeO3因为H2SeO4中非羟基氧数目比H2SeO3多,使得H2SeO4中羟基氢更易电离,故H2SeO4酸性更强
分子晶体sp3杂化CN- 或C22-C <O< NH2SeO4>H2SeO3因为H2SeO4中非羟基氧数目比H2SeO3多,使得H2SeO4中羟基氢更易电离,故H2SeO4酸性更强![]()
【解析】
(1)S原子核外有16个电子,分别位于1s、2s、2p、3s、3p轨道,价电子位于3s、3p轨道,则基态硫原子价层电子的轨道表达式为![]() ,
,
故答案为:![]() ;
;
(2)根据相似相溶原理判断,Ni(CO)4溶于乙醇、CCl4、苯等有机溶剂,所以可判断Ni(CO)4为分子晶体,Ni(CO)4空间构型与甲烷相同,甲烷为正四面体,中心原子为sp3杂化,所以可判断中心原子的杂化轨道类型为sp3杂化;等电子体是指原子总数相同,价电子总数相同的微粒,Ni(CO)4的配位体为CO,O可用N-或C2-代替,所以形成的等电子体可以为:CN- 或C22-,
故答案为:分子晶体;sp3杂化;CN- 或C22- ;
(3)黄血盐[K4Fe(CN)63H2O]中,三种同周期非金属元素为C、N、O,同一周期从左到右第一电离能有增大的趋势,但N原子具有半充满稳定状态,第一电离能大于O,所以第一电离能由小到大顺序为C <O< N,
故答案为:C <O< N;
(4)含氧酸中所含非羟基氧数目越多酸性越强,H2SeO4中非羟基氧数目为2,H2SeO3中非羟基氧数目为1,故酸性H2SeO4>H2SeO3,
故答案为:H2SeO4>H2SeO3;因为H2SeO4中非羟基氧数目比H2SeO3多,使得H2SeO4中羟基氢更易电离,故H2SeO4酸性更强;
(5)根据晶胞结构分析,由于阴离子是面心立方堆积,Ni2+填充在八面体空隙,所以晶胞边长为a=2r(Ni2+)+2r(O2-)=2![]() 69nm+2×140nm=418nm,由晶胞结构可知,一个晶胞中实际拥有4个Ni2+和4个O2-,则晶体的密度
69nm+2×140nm=418nm,由晶胞结构可知,一个晶胞中实际拥有4个Ni2+和4个O2-,则晶体的密度![]() =
=![]() =
=![]() g/cm3。
g/cm3。
故答案为:![]() 。
。