题目内容
【题目】高铁酸盐在能源环保领域有广泛用途。用镍 (Ni)、铁作电极电解浓NaOH溶液制备高铁酸钠(Na2FeO4)的装置如图所示。下列说法正确的是
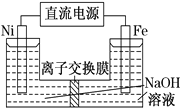
A. 铁是阳极,电极反应为Fe-2e-+2OH-===Fe(OH)2↓
B. 电解一段时间后,镍电极附近溶液的pH减小
C. 每制得1 mol Na2FeO4,理论上可以产生67.2L气体
D. 若离子交换膜为阴离子交换膜,则电解结束后左侧溶液中含有FeO![]()
【答案】D
【解析】试题分析: A.制备高铁酸钠(Na2FeO4),铁失电子生成高铁酸钠,则铁作阳极,电极反应式为Fe+8OH--6e-=FeO42-+4H2O,故A错误;B.镍作阴极,镍电极上水中氢离子放电生成氢气,氢氧根离子浓度增大,所以溶液的pH增大,故B错误;C.不能确定温度和压强,生成气体体积无法确定,故C错误;D.若离子交换膜为阴离子交换膜,则电解结束后由于浓度差左侧溶液中会含有FeO42-,故D正确;

练习册系列答案
相关题目