题目内容
(14分)乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业.实验室利用下图A装置制备乙酸乙酯.
(1)若实验中用乙酸和含18O的乙醇作用,该反应的化学方程式是:
与教材采用的实验装置不同,此装置中采用了球形干燥管,其作用是 .
(2)为了证明浓硫酸在该反应中起到了催化剂和吸水剂的作用,某同学利用上图所示装置进行了以下4个实验.实验开始先用酒精灯微热3min,再加热使之微微沸腾3min.实验结束后充分振荡小试管Ⅱ再测有机层的厚度,实验记录如下:
| 实验编号 | 试管Ⅰ中试剂 | 试管Ⅱ中试剂 | 有机层的厚度/cm |
| A | 2mL乙醇、1mL乙酸、 1mL18mol?L-1 浓硫酸 | 饱和Na2CO3溶液 | 3.0 |
| B | 2mL乙醇、1mL乙酸 | 0.1 | |
| C | 2mL乙醇、1mL乙酸、 3mL 2mol?L-1H2SO4 | 0.6 | |
| D | 2mL乙醇、1mL乙酸、盐酸 | 0.6 |
②分析实验 (填实验编号)的数据,可以推测出浓H2SO4的吸水性提高了乙酸乙酯的产率.
(3)若现有乙酸90g,乙醇138g发生酯化反应得到88g乙酸乙酯,试计算该反应的产率为 .
(4)现拟分离含乙酸、乙醇和水的乙酸乙酯粗产品,如图是分离操作步骤流程图.图中( )内为适当的试剂,【 】内为适当的分离方法.

①试剂a是 ;分离方法②是 ,分离方法③是 .分离方法①是分液,在具体操作中应充分振荡,然后静置,待分层后 (填标号),
A.直接将乙酸乙酯从分液漏斗上口倒出
B.直接将乙酸乙酯从分液漏斗下口放出
C.先将水层从分液漏斗的下口放出,再将乙酸乙酯从下口放出
D.先将水层从分液漏斗的下口放出,再将乙酸乙酯从上口放出
②在得到的A中加入无水碳酸钠粉末,振荡,目的是 .
(5)为充分利用反应物,甲、乙两位同学分别设计了上面图中甲、乙两个装置(乙同学待反应完毕冷却后,再用饱和碳酸钠溶液提取烧瓶中的产物).你认为最合理的是
(1)CH3COOH+CH3CH218OH CH3CO18OC2H5+H2O
CH3CO18OC2H5+H2O
冷凝和防止倒吸;(2)① 3; 4 ;② AC ;
(3) 66.7% ;(4) ①饱和Na2CO3溶液;蒸馏; 蒸馏;D;②除去乙酸乙酯中混有的少量水(或干燥);(5)乙。
解析试题分析:(1)若实验中用乙酸和含18O的乙醇作用,该反应的化学方程式是:CH3COOH+ CH3CH218OH  CH3CO18OC2H5+H2O;与教材采用的实验装置不同,此装置中采用了球形干燥管,其作用是冷凝和防止倒吸;(2)①实验D的目的是与实验C相对照,证明H+对酯化反应具有催化作用.由于在实验C中使用的硫酸是3mL 2mol?L-1,为了使条件与C相同,所以在实验D中应加入一元强酸盐酸的体积和浓度分别是3mL和4mol?L-1。②分析实验A、C 可知:其它条件相同只有硫酸的浓度不同,结构使用浓硫酸反应产生的酯多,说明浓H2SO4的吸水性提高了乙酸乙酯的产率;(3)n(乙酸)=90g÷60g/mol=1.5mol,n(乙醇)=138g÷46g/mol=3mol,由于乙醇过量,所以应该按照乙酸来计算得到的酯的质量。n(乙酸乙酯)=88g÷88g/mol=1mol,则该反应的产率为_1mol÷1.5mol)×100%=66.7%。(4)①试剂a是饱和Na2CO3溶液,通过分液分离得到:A是乙酸乙酯;B是含有乙醇、乙酸钠、碳酸钠的溶液;向乙酸乙酯中加入碳酸钠固体除去其中少量的水,然后过滤得到纯净的乙酸乙酯;将B蒸馏可以得到E:乙醇;溶液是乙酸钠、碳酸钠的溶液;向其中加入浓硫酸,得到乙酸、硫酸钠的混合物,利用二者沸点的不同,通过蒸馏就可以得到乙酸。分离方法①是分液,在具体操作中应充分振荡,然后静置,待分层后先将水层从分液漏斗的下口放出,再将乙酸乙酯从上口放出,故选项是D.②在得到的A中加入无水碳酸钠粉末,振荡,目的是除去乙酸乙酯中混有的少量水(或干燥);(5)为充分利用反应物,甲、乙两位同学分别设计了上面图中甲、乙两个装置(乙同学待反应完毕冷却后,再用饱和碳酸钠溶液提取烧瓶中的产物).由于甲中未发生反应的乙酸乙醇都随着产生的酯挥发出去,所以物质的利用率降低,而乙都回流到反应装置,从而利用率大大提高,所以我认为最合理的是乙。
CH3CO18OC2H5+H2O;与教材采用的实验装置不同,此装置中采用了球形干燥管,其作用是冷凝和防止倒吸;(2)①实验D的目的是与实验C相对照,证明H+对酯化反应具有催化作用.由于在实验C中使用的硫酸是3mL 2mol?L-1,为了使条件与C相同,所以在实验D中应加入一元强酸盐酸的体积和浓度分别是3mL和4mol?L-1。②分析实验A、C 可知:其它条件相同只有硫酸的浓度不同,结构使用浓硫酸反应产生的酯多,说明浓H2SO4的吸水性提高了乙酸乙酯的产率;(3)n(乙酸)=90g÷60g/mol=1.5mol,n(乙醇)=138g÷46g/mol=3mol,由于乙醇过量,所以应该按照乙酸来计算得到的酯的质量。n(乙酸乙酯)=88g÷88g/mol=1mol,则该反应的产率为_1mol÷1.5mol)×100%=66.7%。(4)①试剂a是饱和Na2CO3溶液,通过分液分离得到:A是乙酸乙酯;B是含有乙醇、乙酸钠、碳酸钠的溶液;向乙酸乙酯中加入碳酸钠固体除去其中少量的水,然后过滤得到纯净的乙酸乙酯;将B蒸馏可以得到E:乙醇;溶液是乙酸钠、碳酸钠的溶液;向其中加入浓硫酸,得到乙酸、硫酸钠的混合物,利用二者沸点的不同,通过蒸馏就可以得到乙酸。分离方法①是分液,在具体操作中应充分振荡,然后静置,待分层后先将水层从分液漏斗的下口放出,再将乙酸乙酯从上口放出,故选项是D.②在得到的A中加入无水碳酸钠粉末,振荡,目的是除去乙酸乙酯中混有的少量水(或干燥);(5)为充分利用反应物,甲、乙两位同学分别设计了上面图中甲、乙两个装置(乙同学待反应完毕冷却后,再用饱和碳酸钠溶液提取烧瓶中的产物).由于甲中未发生反应的乙酸乙醇都随着产生的酯挥发出去,所以物质的利用率降低,而乙都回流到反应装置,从而利用率大大提高,所以我认为最合理的是乙。
考点:考查实验室制取乙酸乙酯的反应原理、实验操作、混合物的分离、原料的利用率等知识。

 阅读快车系列答案
阅读快车系列答案假如将我们面前的这张试卷揉成一团,浸入装有稀硫酸的烧杯中,经过充分反应后,烧杯中产生的新物质是什么?
| A.蔗糖 | B.葡萄糖 | C.果糖 | D.纤维素 |
I.乙烯是石油裂解气的主要成分,它的产量通常用来衡量一个国家的石油化工水平。请回答下列问题。
(1)乙烯的结构简式为____________。
(2)下列物质中,不可以通过乙烯加成反应得到的是______(填序号)。
| A.CH3CH3 | B.CH3CHCl2 |
| C.CH3CH2OH | D.CH3CH2Br |
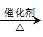 2CH3COOH。若以乙烯为主要原料合成乙酸,其合成路线如下图所示。
2CH3COOH。若以乙烯为主要原料合成乙酸,其合成路线如下图所示。
反应②的化学方程式为____________________________________。
工业上以乙烯为原料可以生产一种重要的合成有机高分子化合物,其反应的化学方程式为____________________________________,反应类型是__________________。
II.在实验室可以用如下图所示的装置制取乙酸乙酯,请回答下列问题。

(1)乙醇、乙酸分子中官能团的名称分别是_________、_________。
(2)试管a中发生反应的化学方程式为
_____________________________________________,
反应类型是______________。
(3)浓H2SO4的作用是:__________________________。
反应开始前,试管b中盛放的溶液是____________。
该溶液的作用是
___________________________________________________________________________________。


 2NO(g) △H >0
2NO(g) △H >0
 )该反应的原子利用率为100%,反应的化学方程式为___________。
)该反应的原子利用率为100%,反应的化学方程式为___________。