题目内容
(14分)汽车在现代生活中扮演着越来越重要的角色,但其尾气(碳氢化合物、氮氧化物及一氧化碳等)带来的环境污染越来越明显,机动车废气排放已成为城市大气污染的重要来源。
(1)设汽油成分为C8H18,若在气缸中汽油高温裂解产生丁烷和丁烯,写出该反应的化学方程
。
(2)气缸中生成NO的反应为:N2(g)+O2(g)  2NO(g) △H >0
2NO(g) △H >0
①汽车启动后,气缸内温度越高,单位时间内NO排放量越大,原因是 。
②1mol空气中含有0.8molN2和0.2molO2,1300℃时在含1mol空气的密闭容器内反应达到平衡。测得NO为8×10-4mol。计算该温度下的平衡常数K≈ 。
(3)尾气中的CO主要来自于汽油不完全燃烧。
①有人设想按下列反应除去CO:2CO(g)=2C(s)+O2(g) △H=+221kJ·mol-1, 简述该设想能否实现的依据: 。
②测量汽车尾气的浓度常用电化学气敏传感器,其中CO传感器可用下图简单表示,则阳极发生的电极反应为 。
(4)在汽车尾气系统中安装催化转换器,可有效减少尾气中的CO、NOx 和碳氢化合物等废气。
已知:N2(g)+O2(g)=2NO(g) △H1=+180kJ/mol
CO(g) +1/2O2(g)= CO2(g) △H2=-283kJ/mol
2NO(g)+ 2CO(g) = 2CO2(g) + N2(g) △H3
则△H3 = kJ·mol-1。
(5)光化学烟雾(含臭氧、醛类、过氧乙酰硝酸酯等)是汽车尾气在紫外线作用下发生光化学反应生成的二次污染物。写出2-丁烯与臭氧按物质的量之比为1:2反应生成乙醛及氧气的化学方程式 。
(1)C8H18 C4H10+ C4H8(2分)
C4H10+ C4H8(2分)
(2)①温度升高,反应速率加快,平衡右移(2分) ②4×10-6(2分)
(3)①该反应是焓增、熵减的反应,任何温度下均不能自发进行(2分)
②CO+H2O-2e-=CO2+2H+(2分)
(4)-746(2分) (5) CH3CH=CHCH3+2O3 2CH3CHO +2O2(2分)
2CH3CHO +2O2(2分)
解析试题分析:⑴根据C8H18在高温裂解产生丁烷和丁烯可写出该反应方程式;
⑵①由于生成NO的反应为吸热反应,温度升高,反应速率加快,平衡右移,导致单位时间内NO排放量越大;
②由于题目未告诉容器体积,令其体积为1L,注意数据的近似处理,平衡时: c(N2)≈0.8mol/L, c(O2) ≈0.2mol/L,c(NO)=8×10-8mol/L,将数据代入K=c2(NO)÷[c(N2)·c(O2)]= 4×10-6;
⑶①由于该反应是焓增,熵减的反应,由ΔG=ΔH-TΔS,在任何温度下均不自发进行;
②CO在阳极上发生氧化反应,先根据得失电子守恒有CO-2e-――CO2,再根据电荷守恒有CO-2e-――CO2+2H+,最后根据原子守恒得CO+H2O-2e-=CO2+2H+;
⑷将两式依次编号①②,将“②×2-①”得第三式,根据盖斯定律得第三式的反应热△H3=(-283kJ/mol)×2-(+180kJ/mol)=-746kJ·mol-1;
⑸根据信息“2-丁烯与臭氧按物质的量之比为1:2反应生成乙醛及氧气”,应用原子守恒写出该反应方程式。
考点:考查化学反应原理。

下列有关高级脂肪酸的叙述中错误的是
| A.都不溶于水 | B.都为固态 | C.都比水轻 | D.其钠盐是肥皂的主要成分 |
下列物质中不能与乙酸反应的是
| A.Na | B.CH3CHO | C.Cu(OH)2 | D.Na2CO3 |
(14分)乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业.实验室利用下图A装置制备乙酸乙酯.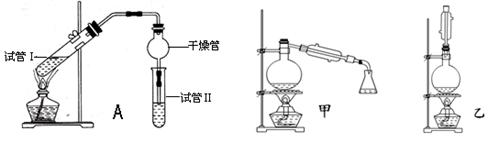
(1)若实验中用乙酸和含18O的乙醇作用,该反应的化学方程式是:
与教材采用的实验装置不同,此装置中采用了球形干燥管,其作用是 .
(2)为了证明浓硫酸在该反应中起到了催化剂和吸水剂的作用,某同学利用上图所示装置进行了以下4个实验.实验开始先用酒精灯微热3min,再加热使之微微沸腾3min.实验结束后充分振荡小试管Ⅱ再测有机层的厚度,实验记录如下:
| 实验编号 | 试管Ⅰ中试剂 | 试管Ⅱ中试剂 | 有机层的厚度/cm |
| A | 2mL乙醇、1mL乙酸、 1mL18mol?L-1 浓硫酸 | 饱和Na2CO3溶液 | 3.0 |
| B | 2mL乙醇、1mL乙酸 | 0.1 | |
| C | 2mL乙醇、1mL乙酸、 3mL 2mol?L-1H2SO4 | 0.6 | |
| D | 2mL乙醇、1mL乙酸、盐酸 | 0.6 |
②分析实验 (填实验编号)的数据,可以推测出浓H2SO4的吸水性提高了乙酸乙酯的产率.
(3)若现有乙酸90g,乙醇138g发生酯化反应得到88g乙酸乙酯,试计算该反应的产率为 .
(4)现拟分离含乙酸、乙醇和水的乙酸乙酯粗产品,如图是分离操作步骤流程图.图中( )内为适当的试剂,【 】内为适当的分离方法.

①试剂a是 ;分离方法②是 ,分离方法③是 .分离方法①是分液,在具体操作中应充分振荡,然后静置,待分层后 (填标号),
A.直接将乙酸乙酯从分液漏斗上口倒出
B.直接将乙酸乙酯从分液漏斗下口放出
C.先将水层从分液漏斗的下口放出,再将乙酸乙酯从下口放出
D.先将水层从分液漏斗的下口放出,再将乙酸乙酯从上口放出
②在得到的A中加入无水碳酸钠粉末,振荡,目的是 .
(5)为充分利用反应物,甲、乙两位同学分别设计了上面图中甲、乙两个装置(乙同学待反应完毕冷却后,再用饱和碳酸钠溶液提取烧瓶中的产物).你认为最合理的是
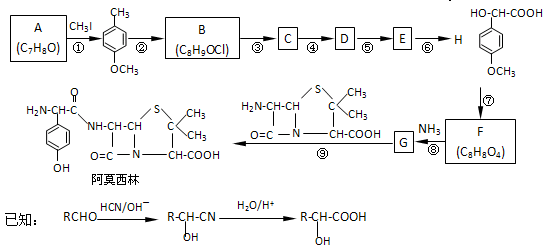
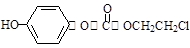 ,该物质在NaOH水溶液中加热反应时的化学方程式为 。
,该物质在NaOH水溶液中加热反应时的化学方程式为 。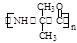 的合成路线流程图(无机试剂任用)。
的合成路线流程图(无机试剂任用)。
 CH3CH2-OH+HR,现有如下转化关系:
CH3CH2-OH+HR,现有如下转化关系: 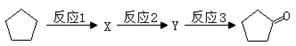
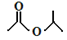 ,请写出它与NaOH溶液反应的化学方程式 :
,请写出它与NaOH溶液反应的化学方程式 :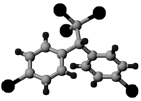
 ) 是日常生活中常用的两种合成高分子材料,可由某烃经下列反应得到。
) 是日常生活中常用的两种合成高分子材料,可由某烃经下列反应得到。
 2H2O +
2H2O + 
 ,起始原料的某烃的结构简式为 ,最少用 步反应,可以合成产物。
,起始原料的某烃的结构简式为 ,最少用 步反应,可以合成产物。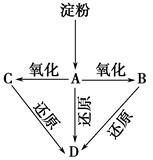
 最难。
最难。