题目内容
-定条件下,在体积为VL的密闭容器中发生如下反应 一段时间后达到化学平衡状态。改变某一条件,下列说法正确的是
一段时间后达到化学平衡状态。改变某一条件,下列说法正确的是
| A.若升高温度,反应混合气体密度不变时即达到新平衡状态 |
| B.若增大B的浓度,△H减小 |
| C.若使用适当催化剂,A的转化率增大 |
| D.若增大压强,平衡向右移动,则m+n>p+q |
A
解析

练习册系列答案
 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案
相关题目
某温度下,对可逆反应2X(g) + Y(g) 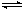 3Z(g) + W(s) ΔH>0 的叙述正确的是
3Z(g) + W(s) ΔH>0 的叙述正确的是
| A.加入少量W,逆反应速率增大,平衡向左移动 |
| B.增大压强,正反应速率增大,逆反应速率减小 |
| C.温度、体积不变,充入He气增大压强,反应速率会加快 |
| D.升高温度,混合气体的平均相对分子质量减小 |
2SO2+O2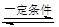 2SO3是工业上制硫酸的反应。下列关于该反应的说法正确的是( )
2SO3是工业上制硫酸的反应。下列关于该反应的说法正确的是( )
| A.减少O2的浓度能加快反应速率 |
| B.降低体系温度能加快反应速率 |
| C.使用催化剂不影响反应速率 |
| D.一定条件下达到反应限度时SO2部分转化为SO3 |
将几滴KSCN(SCN-是“类卤离子”,与氯离子性质相似)溶液加入酸性的含有Fe3+的溶液中,溶液变成血红色。将该红色溶液分为两份,①一份中加入适量KMnO4溶液,红色褪去;②向另一份中通入SO2,红色也褪去。
下列说法不正确的是
| A.①红色褪去的原因可能是KMnO4将SCN-氧化,使[Fe(SCN)]2+消失 |
| B.[Fe(SCN)]2+中Fe3+与SCN-以配位键结合。 |
| C.②红色褪去的原因是SO2具有漂白性 |
| D.SCN-在适当条件下可失去电子被氧化剂氧化为(SCN)2 |
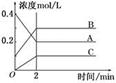
 2B(g)+C(g)
2B(g)+C(g)
 AB来说,常温下按以下情况进行反应:
AB来说,常温下按以下情况进行反应: 2C的反应来说,以下化学反应速率的表示中,反应速率最快的是 ( )
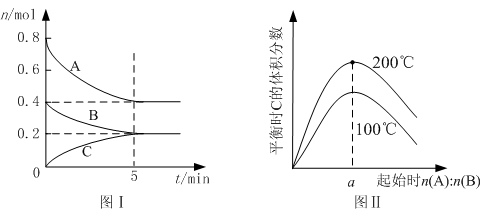
2C的反应来说,以下化学反应速率的表示中,反应速率最快的是 ( ) zC(g),图I表示200℃时容器中A、B、C物质的量随时间的变化,图Ⅱ表示不同温度下平衡时C的体积分数随起始n(A):n(B)的变化关系。则下列结论正确的是 ( )
zC(g),图I表示200℃时容器中A、B、C物质的量随时间的变化,图Ⅱ表示不同温度下平衡时C的体积分数随起始n(A):n(B)的变化关系。则下列结论正确的是 ( )