题目内容
2SO2+O2 2SO3是工业上制硫酸的反应。下列关于该反应的说法正确的是( )
2SO3是工业上制硫酸的反应。下列关于该反应的说法正确的是( )
| A.减少O2的浓度能加快反应速率 |
| B.降低体系温度能加快反应速率 |
| C.使用催化剂不影响反应速率 |
| D.一定条件下达到反应限度时SO2部分转化为SO3 |
D
解析试题分析:A、减少O2的浓度能减慢反应速率,错误;B、温度降低,反应速率减慢,错误;C、一般使用催化剂可以加快反应速率,错误;D、可逆反应的特点是反应物不能全部转化为生成物,所以一定条件下达到反应限度时SO2部分转化为SO3,正确,答案选D。
考点:考查条件对反应速率、反应限度的理解

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案
相关题目
下列有关说法正确的是
| A.25oC与60oC时,纯水的pH相等 |
| B.CaCO3难溶于稀硫酸,也难溶于醋酸 |
| C.电解法精炼铜时,以粗铜作阴极,纯铜作阳极 |
| D.反应NH3(g)+HCl(g)=NH4Cl(s)在室温下可自发进行,则该反应的△H<0 |
将氨基甲酸铵晶体置于特制的密闭真空容器中(假设容器体积不变,固体体积忽略不计),在恒定温度下使其达到分解平衡:H2NCOONH4(s) 2NH3(g)+ CO2(g)。不能说明该分解反应达到平衡状态的是 ( )
2NH3(g)+ CO2(g)。不能说明该分解反应达到平衡状态的是 ( )

| A.单位时间内生成1 mol CO2的同时消耗2 mol NH3 |
| B.形成6个N—H键的同时有2个C=O键断裂 |
| C.容器中CO2与NH3的物质的量之比保持不变 |
| D.混合气体的密度不再改变的状态 |
决定化学反应速率的根本因素是
| A.温度和压强 | B.反应物的浓度 |
| C.物质自身的性质 | D.催化剂的加入 |
煤气是生活中常用的燃料,制取水煤气的反应为C(s)+H2O(g) CO(g)+H2(g)。该反应在一容积可变的密闭容器中进行时,改变下列条件会对反应速率产生影响的是
CO(g)+H2(g)。该反应在一容积可变的密闭容器中进行时,改变下列条件会对反应速率产生影响的是
①增加少量的碳 ②将容器的体积缩小一半 ③保持体积不变,充入N2使体系压强增大 ④保持压强不变,充入N2使体系体积增大
| A.①② | B.②③ | C.②④ | D.①④ |
在一密闭容器中,放入镍粉并充入一定量的CO气体,一定条件下发生反应:Ni(s)+4CO(g)  Ni(CO)4(g),已知该反应在25 ℃和80 ℃时的平衡常数分别为5×104、2。下列说法正确的是
Ni(CO)4(g),已知该反应在25 ℃和80 ℃时的平衡常数分别为5×104、2。下列说法正确的是
| A.恒温恒容下,向容器中再充入少量Ni(CO)4(g),达新平衡时,Ni(CO)4的百分含量将增大 |
| B.在80 ℃时,测得某时刻Ni(CO)4、CO浓度均为0.5 mol·L-1,则此时v(正)<v(逆) |
| C.恒温恒压下,向容器中再充入少量的Ar,上述平衡将正向移动 |
| D.上述生成Ni(CO)4(g)的反应为吸热反应 |
-定条件下,在体积为VL的密闭容器中发生如下反应 一段时间后达到化学平衡状态。改变某一条件,下列说法正确的是
一段时间后达到化学平衡状态。改变某一条件,下列说法正确的是
| A.若升高温度,反应混合气体密度不变时即达到新平衡状态 |
| B.若增大B的浓度,△H减小 |
| C.若使用适当催化剂,A的转化率增大 |
| D.若增大压强,平衡向右移动,则m+n>p+q |
下列各图与表述不一致的是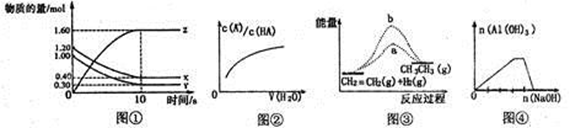
| A.图①表示T℃时,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线。若T℃时,若起始时X为1.20mol,Y为1.00mol,则平衡时Y的转化率为80% |
| B.图②中曲线表示向弱酸HA的稀溶液中加水稀释 |
| C.图③b曲线表示反应CH2=CH2(g)+H2(g)→CH3-CH3(g) △H<0,使用催化剂时,反应过程中的能量变化 |
| D.图④表示向NH4Al(SO4)2溶液中滴加过量的NaOH溶液 |
对可逆反应N2(g)+3H2(g) 2NH3(g),△H=-92.4 kJ.mol-1下列叙
2NH3(g),△H=-92.4 kJ.mol-1下列叙
述正确的是
| A.达到化学平衡时,若升高温度,则正反应速率减小,逆反应速率增大 |
| B.若单位时间内消耗x mol N2,同时生成2x mol NH3,则反应达到平衡状态 |
| C.若达到平衡时,共放出46.2kJ热量,则有l mo1NH3(g)生成 |
| D.达到平衡后,将容器体积减小为原来的一半,重新达到平衡后,c(NH3)变为原平衡时的2倍 |