题目内容
【题目】向一体积为2L的恒容密闭容 器里充入1mol N2和3mol H2 , 在一定温度下发生反应:N2(g)+3H2(g)2NH3(g);△H<0.10秒时达到平衡,c(NH3)为0.4mol/L.下列说法正确的是( )
A.向该容器中充入N2 , 平衡正向移动
B.降低温度能使混合气体的密度增大
C.该反应达平衡时H2的转化率为20%
D.研发高效催化剂可大大提高N2的转化率
【答案】A
【解析】解:A.该容器中充入N2 , 反应物浓度增大,则平衡正向移动,故A正确;B.恒容且气体的质量不变,则降低温度平衡正向移动,但混合气体的密度不变,故B错误;
C.达到平衡,c(NH3)为0.4mol/L,由反应可知,转化的c(H2)为0.4mol/L× ![]() =0.6mol/L,则达平衡时H2的转化率为
=0.6mol/L,则达平衡时H2的转化率为 ![]() =40%,故C错误;
=40%,故C错误;
D.催化剂催平衡移动无影响,则研发高效催化剂不能提高N2的转化率,故D错误;
故选A.
【考点精析】解答此题的关键在于理解化学平衡状态本质及特征的相关知识,掌握化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效).

 巧学巧练系列答案
巧学巧练系列答案 课课练江苏系列答案
课课练江苏系列答案【题目】按要求写出方程式.
(1)碳酸氢铵溶液中加入过NaOH溶液,并加热(写出离子方量程式) .
(2)已知4℃时四种化合物在水中和液氨中的溶解度如表:
AgNO3 | Ba(NO3)2 | AgCl | BaCl2 | |
H2O (液) | 170g | 9.2g | 1.5×10﹣4g | 33.3g |
NH3(液) | 86g | 97.2g | 0.8g | 0g |
上述四种物质在水中形成复分解反应的离子方程式为 , 在液氨中发生复分解反应的化学方程式为 .
【题目】如图a、b、c、d均为铂电极,供选择的电解质溶液如下表:
组 | A | B | C | D |
甲槽 | NaOH | Cu(N O3)2 | KCl | Na2SO4 |
乙槽 | CuSO4 | NaCl | AgNO3 | NaNO3 |
要满足的条件是:①工作一段时间后,甲槽电解液pH上升,而乙槽电解液pH下降;②b、c两极放电离子的物质的量相等.则应选用的电解液是( )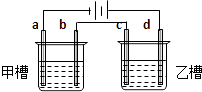
A.A
B.B
C.C
D.D