题目内容
【题目】某化学实验小组设计了如图1装置证明和比较SO2和氯水的漂白性,其中A装置分液漏斗中为70%的硫酸,烧瓶中为亚硫酸钠固体,B、D中为品红溶液,C中为NaOH溶液. 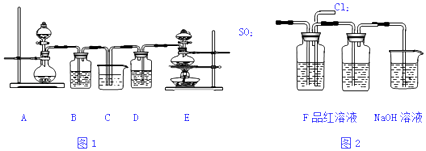
(1)实验时用装置A制备SO2气体,写出反应的化学方程式
(2)反应开始后,发现B、D两个装置中的品红溶液都褪色,停止通气后,取B、D溶液于试管中分别加热,两个试管中的现象分别为:BD . 解释B中对应现象的原因 .
(3)装置C的作用是
(4)该实验小组的甲、乙两位同学利用上述两发生装置按如图装置继续进行实验:
通气一段时间后,甲同学实验过程中品红溶液几乎不褪色,而乙同学的实验现象是品红溶液随时间的推移变得越来越浅.试根据该实验装置和两名同学的实验结果回答问题.
①两同学在气体进入品红溶液之前,先将气体通过F装置,F中可盛装浓硫酸.其目的是使SO2和Cl2混合均匀并且 .
②试分析甲同学实验过程中,品红溶液不褪色的原因是:(用离子方程式说明)
③你认为乙同学是怎样做到让品红溶液变得越来越浅的?
【答案】
(1)Na2SO3+H2SO4=Na2SO4+SO2↑+H2O
(2)溶液恢复红色;溶液仍无色;二氧化硫与品红生成不稳定的无色物质,加热时无色物质分解又生红色的品红
(3)吸收多余的SO2和Cl2 , 防止污染环境
(4)通过观察气泡控制气体的流速;SO2+Cl2+2H2O=4H++SO42﹣+2Cl﹣;控制两种气体通入的量,使其物质的量不相等(或使其比例不等于1:1)
【解析】解:(1)硫酸与亚硫酸钠反应生成硫酸钠、二氧化硫和水,反应方程式为:Na2SO3+H2SO4=Na2SO4+SO2↑+H2O,所以答案是:Na2SO3+H2SO4=Na2SO4+SO2↑+H2O;(2)SO2使品红褪色,生成不稳定的无色物质,可以看作是一个化合反应,该生成的无色物质不很稳定,受热又能分解放出SO2 , 而恢复原来的红色,氯气使品红褪色是氧化性漂白,不可还原,无法恢复,
所以答案是:溶液恢复红色;溶液仍无色;二氧化硫与品红生成不稳定的无色物质,加热时无色物质分解又生红色的品红;(3)氯气和二氧化硫都有毒,不能直接排放到空气中,所以用氢氧化钠吸收过量的二氧化硫和氯气,防止污染空气,
所以答案是:吸收多余的SO2和Cl2 , 防止污染环境;(4)①F中可盛装浓硫酸,其目的是使SO2和Cl2混合均匀并且通过观察气泡控制气体的流速;
所以答案是:通过观察气泡控制气体的流速;
②氯气和二氧化硫在水溶液中恰好完全反应,反应的离子方程式为:SO2+Cl2+2H2O=4H++SO42﹣+2Cl﹣ , 生成的硫酸和盐酸不具有漂白性,所以品红溶液不褪色,
所以答案是:SO2+Cl2+2H2O=4H++SO42﹣+2Cl﹣;
③当通入的二氧化硫或者氯气中一种气体过量,过量的氯气或者二氧化硫气体能够使品红褪色,
所以答案是:控制两种气体通入的量,使其物质的量不相等(或使其比例不等于1:1).

【题目】在下列反应中,水既不是氧化剂,也不是还原剂的是( )
A.2Na+2H2O=2NaOH+H2↑
B.C12+H2O=HC1+HC1O
C.2F2+2H2O=4HF+O2
D.2H2O ![]() 2H2↑+O2↑
2H2↑+O2↑
【题目】在一定温度下,将气体X和气体Y各0.16mol充入10L恒容密闭容器中,发生反应X(g)+Y(g)2Z(g)△H<0,一段时间后达到平衡,反应过程中测定的数据如下表.下列说法正确的是( )
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
A.反应前2min的平均速率v(Z)=2.0×10﹣5mol/(Lmin)
B.其他条件不变,降低温度,反应达到新平衡前v(逆)>v(正)
C.该温度下此反应的平衡常数K=1.44
D.其他条件不变,再充入0.2mol Z,平衡时X的体积分数增大
