题目内容
【题目】为测定某有机化合物A的结构,进行了如下实验。
【分子式的确定】
(1)将有机物A置于氧气流中充分燃烧,实验测得:生成5.4g H2O和8.8g CO2,消耗氧气6.72L(标准状况)。则该有机物中各元素的原子个数比是 。
(2)该有机化合物的相对分子质量为46,则其分子式是 。
(3)预测A的可能结构并写出结构简式 。
【结构简式的确定】
(4)经测定,在标准状况下0.2mol有机物A与足量金属钠反应生成2.24L的氢气,则A的结构简式为 。理由__________________。
【性质实验】
(5)A在一定条件下脱水可生成B,用B制备氯乙烷原子利用率为100%,请写出上述由B制备氯乙烷反应的化学方程式: 。
【答案】(1)C:H:O=2:6:1 (2)C2H6O (3)C2H5OH CH3OCH3
(4)C2H5OH 2mol有机物与钠反应生成1摩H2 ,说明有机物分子中含一个活泼氢原子
(5)CH2=CH2+HCl![]() CH3CH2Cl
CH3CH2Cl
【解析】
试题分析:(1)根据元素守恒,n(H)=![]() =0.6mol,n(C)=8.8g÷44mol=0.2mol,根据氧元素守恒,有机物的氧n(O)+
=0.6mol,n(C)=8.8g÷44mol=0.2mol,根据氧元素守恒,有机物的氧n(O)+![]() =5.4g÷18g/mol+
=5.4g÷18g/mol+![]() ,解得:n(O)=0.1mol,则n(C):n(H):n(O)=0.2:0.6:0.1=2:6:1;
,解得:n(O)=0.1mol,则n(C):n(H):n(O)=0.2:0.6:0.1=2:6:1;
(2)有机物的最简式为C2H6O,分子量为46,则分子式为C2H6O;
(3)醇和醚互为同分异构体,可能结构简式为CH3CH2OH、CH3OCH3;
(4)能和金属钠反应,说明含有羟基,物质类别属于醇,其结构简式为CH3CH2OH。根据题目中所给数量关系,1mol该有机物能生成0.5mol氢气,说明A中有一个氢原子不同于其它五个原子,即机物分子中含一个活泼氢原子;
(5)乙醇脱水得到B,用B制备氯乙烷原子利用率为100%,说明发生消去反应,即B为CH2=CH2,B和HCl发生加成反应的方程式为CH2=CH2+HCl![]() CH3CH2Cl。
CH3CH2Cl。

 阅读快车系列答案
阅读快车系列答案【题目】A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,A与D同主族;C与E同主族;B、C同周期;B原子最外层电子数比其次外层电子数多2;A是周期表中半径最小的元素,C的最外层电子数是内层电子的3倍;F元素是同周期元素中原子半径最小的主族元素。A、B、C、D、E形成的化合物甲、乙、丙、丁的组成如表所示:
化合物 | 甲 | 乙 | 丙 | 丁 |
化学式 | A2C | A2C2 | D2C2 | D2E |
回答下列问题:
(1)指出元素F在周期表中的位置__________________。
(2)化合物乙的电子式为_____________,用电子式表示形成化合物丁的过程_____ 。
(3)写出丙与甲反应的离子方程式:___________________。
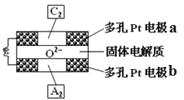
(4)固体氧化物燃料电池是以固体氧化锆—氧化钇为电解质,这种固体电解质在高温下允许O2–在其间通过,该电池的工作原理如图所示,其中多孔Pt电极a、b分别是气体C2、A2的载体。该电池的负极为____(填a或b);O2–流向____极(填“正”或“负”);该电池的正极反应式为 _____。
【题目】(1)用正确的序号填空:
①12C、13C、14C; ②红磷和白磷; ③H2O和D2O;④CH3CH2OH与CH3OCH3; ⑤CH4和CH3CH3 ;
互为同位素的是 ; 互为同素异形体的是 ;
互为同分异构体的是 ; 互为同系物的是
(2)由A、B、C、D四种金属按下表中装置进行实验。
装置 |
|
|
|
现象 | 金属A不 断溶解 | C的质 量增加 | A上有气 体产生 |
根据实验现象回答下列问题:
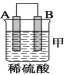
①装置甲中作正极的是_____ ___ (填“A”或“B”)。
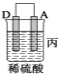
②装置乙溶液中Cu2+向_____ __极移动(填“B”或“C”)。
③装置丙中金属A上电极反应属于___ ___(填“氧化反应”或“还原反应”)。
④四种金属活动性由强到弱的顺序是____ ___。