题目内容
【题目】A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,A与D同主族;C与E同主族;B、C同周期;B原子最外层电子数比其次外层电子数多2;A是周期表中半径最小的元素,C的最外层电子数是内层电子的3倍;F元素是同周期元素中原子半径最小的主族元素。A、B、C、D、E形成的化合物甲、乙、丙、丁的组成如表所示:
化合物 | 甲 | 乙 | 丙 | 丁 |
化学式 | A2C | A2C2 | D2C2 | D2E |
回答下列问题:
(1)指出元素F在周期表中的位置__________________。
(2)化合物乙的电子式为_____________,用电子式表示形成化合物丁的过程_____ 。
(3)写出丙与甲反应的离子方程式:___________________。
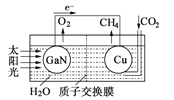
(4)固体氧化物燃料电池是以固体氧化锆—氧化钇为电解质,这种固体电解质在高温下允许O2–在其间通过,该电池的工作原理如图所示,其中多孔Pt电极a、b分别是气体C2、A2的载体。该电池的负极为____(填a或b);O2–流向____极(填“正”或“负”);该电池的正极反应式为 _____。

【答案】(1)第三周期第ⅦA族 (2)![]()
![]()
(3)2Na2O2+2H2O=4Na++4OH-+O2↑ (4)b 负 O2+4e-=2O2-
【解析】试题分析:原子序数依次增大的A、B、C、D、E、F六种短周期元素,B原子最外层电子数比其次外层电子数多2,原子只能有2个电子层,最外层电子数为4,则B为碳元素;A是周期表中半径最小的元素,则A为H元素;C的最外层电子数是内层电子的3倍,原子只能有2个电子层,最外层电子数为6,故C为O元素;C与E同主族,则E为S元素;A与D同主族,D的原子序数大于氧,故D为Na;F的原子序数最大,且F元素是同周期元素中原子半径最小的主族元素,故F为Cl,可推知甲为H2O、乙为H2O2、丙为Na2O2、丁为Na2S。
(1)元素F为Cl,在周期表中的位置为第三周期第ⅦA族;
(2)乙为H2O2,属于共价化合物,电子式为![]() ;硫化钠是离子化合物,用电子式表示形成化合物Na2S的过程为
;硫化钠是离子化合物,用电子式表示形成化合物Na2S的过程为![]() ;
;
(3)丙与甲反应的离子方程式为2Na2O2+2H2O=4Na++4OH-+O2↑;
(4)固体氧化物燃料电池是以固体氧化锆-氧化钇为电解质,这种固体电解质在高温下允许O2-在其间通过,该电池的工作原理如图所示,其中多孔Pt电极a、b分别是气体O2、H2的载体。负极发生氧化反应,氢气在负极失去电子,该电池的负极为b,O2-流向负极,正极发生还原反应,氧气在正极获得电子生成氧离子,该电池的正极反应式为O2+4e-=2O2-。

 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案【题目】X、Y、Z是短周期三种元素,它们在周期表中的位置如图所示。试回答:
X | ||
Y | ||
Z |
(1)X元素单质的化学式是__________________________________。
(2)Z元素的原子结构示意图为________________________________。
(3)Y在元素周期表中的位置是______________________。
(4)与Z同主族的下一周期元素的原子序数是________。