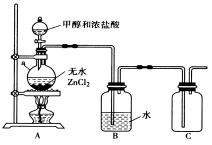
题目内容
【题目】将海水淡化与浓缩海水资源化结合起来是综合利用海水的重要途径之一。浓缩海水中的Br-、Mg2+可通过一系列工艺流程提取出来。
(1)如图是采用膜分离技术淡化海水的示意图,淡化膜可让水分子通过,而海水中其他离子不能通过。加压后,左侧海水中增加的是 (填字母)
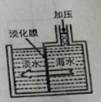
A.溶质质量
B.溶剂质量
C.溶质的质量分数
(2)在浓缩海水中通入氯气,生成Br2,有关的离子方程式是________ _____,该反应中的氧化剂是_____________,生成的Br2可用热空气法吹出的原因_____________。
(3)从海水中提取镁的主要步骤如下:

①操作a是
②试剂X是 ,A与X反应的离子方程式 。
③为检验MgCl2溶液中是否含有NaCl残留,实验操作是 。
④生产出的镁在运输途中应防雨淋,原因是 (用化学方程式表示)。
【答案】(1)B (2)Cl2+2Br-=2Cl-+Br2 Cl2 Br2易挥发
(3)①过滤 ②盐酸 Mg(OH)2+2H+=Mg2++2H2O ③进行焰色反应 ④Mg+2H2O=Mg(OH)2+H2↑
【解析】
试题分析:(1)A.溶质不能通过淡化膜,所以溶质质量是不变的,A项错误;B.水通过淡化膜向左侧移动了,所以溶剂质量增加了,B项正确;C.溶剂质量增加,溶质质量不变,则溶质的质量分数减小了,C项错误;答案选B。
(2)在浓缩海水中富含Br-,通入氯气,氯气将Br-氧化成Br2,反应的离子方程式是Cl2+2Br-=2Cl-+Br2,该反应中氯元素的化合价由0价降低到-1价,则氧化剂是Cl2,因为Br2易挥发,则生成的Br2可用热空气法吹出。
(3)①向海水中通入石灰水会生产氢氧化镁沉淀,分离溶液和难溶物的操作a为过滤。
②向氢氧化镁沉淀中加入盐酸可得到氯化镁,则试剂X是盐酸,Mg(OH)2与盐酸反应的离子方程式为Mg(OH)2+2H+=Mg2++2H2O;
③鉴别MgCl2和NaCl两种化合物,由于它们有共同的Cl-,所以只能通过焰色反应来检验MgCl2溶液中是否含有NaCl残留。
④因为Mg+2H2O=Mg(OH)2+H2↑,所以生产出的镁在运输途中应防雨淋。