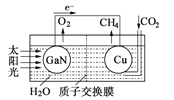
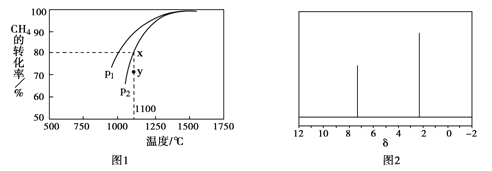
题目内容
【题目】[化学—选修物质结构与性质]
铁触媒是重要的催化剂,CO易与铁触媒作用导致其失去催化活性:Fe+5CO=Fe(CO)5;除去CO的化学反应方程式为:[Cu(NH3)2]OOCCH3+CO+NH3=[Cu(NH3)3(CO)]OOCCH3。
请回答下列问题:
(1)C、N、O的电负性由大到小的顺序为 ,基态Fe原子的价电子排布式为 。
(2)Fe(CO)5又名羰基铁,常温下为黄色油状液体,则Fe(CO)5的晶体类型是 ,Fe(CO)5在空气中燃烧后剩余固体呈红棕色,其化学方程式为 。
(3)配合物[Cu(NH3)2]OOCCH3中碳原子的杂化类型是 ,配体中提供孤对电子的原子是 。
(4)用[Cu(NH3)2]OOCCH3除去CO的反应中,肯定有 形成。
a.离子键 b.配位键 c.非极性键 d.б键
(5)单质铁的晶体在不同温度下有两种堆积方式,晶胞分别如图所示,面心立方晶胞和体心立方晶胞中实际含有的铁原子个数之比为 ,面心立方堆积与体心立方堆积的两种铁晶体的密度之比为 (写出已化简的比例式即可)。

【答案】(1)O>N>C; 3d64s2
(2)分子晶体 ![]()
(3)sp2、sp3 N
(4)bd
(5)2:1 ![]()
【解析】
试题分析:(1)同周期由左向右元素的电负性呈递增趋势,C、N、O的电负性由大到小的顺序为O>N>C,铁为26号元素,根据构造原理确定,基态Fe原子的价电子排布式为3d64s2。
(2)根据题意知Fe(CO)5又名羰基铁,常温下为黄色油状液体,熔点较低,则Fe(CO)5的晶体类型是分子晶体,Fe(CO)5在空气中燃烧生成氧化铁和二氧化碳,化学方程式为![]() 。
。
(3)配合物[Cu(NH3)2]OOCCH3中,酯基中碳原子的杂化类型是sp2,甲基中碳原子的杂化类型是sp3,配体中提供孤对电子的原子是N原子。
(4)用[Cu(NH3)2]OOCCH3除去CO的反应中,肯定有配位键、б键形成,选bd。
(5)根据晶胞结构利用切割法分析,面心立方晶胞中含有的铁原子个数为:8×1/8+6×1/2=4,体心立方晶胞中含有的铁原子数目为:8×1/8+1=2,实际含有的铁原子个数之比为2:1;设铁原子半径为r,面心立方堆积晶胞的棱长为a1,则![]() a1=4r,体心立方堆积晶胞的棱长为a2,则
a1=4r,体心立方堆积晶胞的棱长为a2,则![]() a2=4r,两种铁晶体的密度之比为
a2=4r,两种铁晶体的密度之比为![]() 。
。

 孟建平错题本系列答案
孟建平错题本系列答案 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案