题目内容
【题目】A、B、C、D四种元素,原子序数依次增大,A原子的最外层上有4个电子;B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体E,D的L层电子数等于K、M两个电子层上的电子数之和。
(1)A为 ,B为 ,C为 (填元素符号)。
(2)E的电子式为 。
(3)B、C、D简单离子的半径由大到小的顺序为 (填离子符号)。
(4)B和D非金属性较强的是 (填元素符号)。
(5)写出D的最高价氧化物的水化物和A单质反应的化学方程式: 。
【答案】(1)C,O,Na (2)![]() (3)S2->O2->Na+
(3)S2->O2->Na+
(4)O (5) 2H2SO4(浓)![]() CO2↑+2SO2↑+2H2O
CO2↑+2SO2↑+2H2O
【解析】试题分析:A、B、C、D四种元素,原子序数依次增大,A原子的最外层上有4个电子,则A是C或Si;B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体E,所以E是过氧化钠,B是O,C是Na,则A是C;D的L层电子数等于K、M两个电子层上的电子数之和,所以D的M层电子数是8-2=6,则D是S。
(1)根据以上分析可知A为C,B为O,C为Na。
(2)过氧化钠的电子式为![]() 。
。
(3)离子的核外电子层数越多,离子半径越大,核外电子排布相同的离子,其中离子半径随原子序数的增大而减小,则B、C、D简单离子的半径由大到小的顺序为S2->O2->Na+。
(4)同主族自上而下非金属性逐渐减弱,则B和D非金属性较强的是O。
(5)D的最高价氧化物的水化物是硫酸,和A单质反应的化学方程式为2H2SO4(浓)![]() CO2↑+2SO2↑+2H2O。
CO2↑+2SO2↑+2H2O。

 备战中考寒假系列答案
备战中考寒假系列答案【题目】研究小组用下图装置制取Cl2,证明产生的气体中含有HCl。
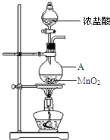
(1)仪器A的名称为_________;A中反应的离子方程式为______________________;
(2)甲同学将A中产生的气体通入下列溶液:
实验序号 | 试剂 | 现象 |
a | 紫色石蕊溶液 | ____________________________ |
b | AgNO3溶液 | 出现白色沉淀 |
①实验a中的现象为______________________;
②不能证明产生的气体中含有HCl的实验是______________(填字母序号);
(3)已知将HCl气体通入饱和食盐水中有白色固体析出.乙同学将A中产生的气体通入饱和食盐水中,有白色固体析出,但该实验不能证明气体中含有HCl,结合化学用语解释其原因______________;
(4)已知:2S2O32-+I2═S4O62-+2I-.丙同学将A中产生的气体通入蒸馏水中,得到溶液X,进行以下实验证明气体中含有HCl.
I.测定X中溶解的Cl2.取25.00mL溶液X,加入过量KI溶液,然后用0.04molL-1 Na2S2O3溶液滴定生成
的I2,达滴定终点时消耗Na2S2O3溶液V mL.
Ⅱ.测定X中Cl元素总量.另取25.00mL溶液X,选用适当的还原剂将溶解的Cl2全部还原为Cl-,再用0.10molL-1 AgNO3溶液滴定所得溶液中的Cl-.
①X中的HClO不会影响I的测定结果,原因是_________________________;
②由I、Ⅱ中实验数据可证明A中产生的气体中含有HCl,则Ⅱ中消耗0.10molL-1 AgNO3溶液的体积应大于____________________mL(用含V的代数式表示)。
【题目】X、Y、Z是短周期三种元素,它们在周期表中的位置如图所示。试回答:
X | ||
Y | ||
Z |
(1)X元素单质的化学式是__________________________________。
(2)Z元素的原子结构示意图为________________________________。
(3)Y在元素周期表中的位置是______________________。
(4)与Z同主族的下一周期元素的原子序数是________。