题目内容
【题目】能够正确表示下列变化的离子方程式是
A.醋酸钠的水解:CH3COOH+H2OCH3COO+H3O+
B.电解熔融MgCl2:Mg2++2Cl![]() Mg+Cl2↑
Mg+Cl2↑
C.MnO2 与浓盐酸共热:MnO2+4HCl![]() Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O
D.K2S溶液中滴加几滴FeCl3溶液:![]()
【答案】B
【解析】
A.醋酸钠的水解:CH3COO-+H2O![]() CH3COOH+OH-,故A错误;
CH3COOH+OH-,故A错误;
B.电解熔融MgCl2生成镁和氯气:Mg2++2Cl![]() Mg+Cl2↑,故B正确;
Mg+Cl2↑,故B正确;
C.MnO2 与浓盐酸共热:MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O,故C错误;
Mn2++Cl2↑+2H2O,故C错误;
D.K2S溶液中滴加几滴FeCl3溶液,过量的硫离子与亚铁离子生成FeS沉淀:![]() ,故D错误;
,故D错误;
故选B。

【题目】“环境就是民生,青山就是美丽,蓝天也是幸福。“拥有天蓝、地绿、水净的美好家园,是每个中国人的梦想。回答下列问题:
(1)排放到大气中的氮的氧化物,会造成___污染。
(2)化肥、炼油、稀土、钢铁等工业都会排放出高浓度的氨氮废水。氨氨废水是造成河流及湖泊富营养化的主要因素。
①某氮肥厂产生的氨氮废水中的氮元素多以NH4+和NH3·H2O形式存在,为达到变废为宝回收利用的目的。可采取的方法是___。
②某团队设计处理流程如下:
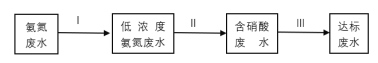
过程Ⅱ为硝化过程,在微生物的作用下实现NH4+→NO2-→NO3-的转化,在碱性条件下NH4+被氧气氧化成NO3-的总反应离子方程式为___。
过程Ⅲ为反硝化过程,向一定条件下的废水中加入甲醇(CH3OH)实现HNO3→NO2-→N2的转化,将lmol NO2-完全转化为N2,转移的电子数为___。
(3)磷酸生产及煤燃烧产生的废气SO2等会对大气造成污染。
①为防止工业煤燃烧产生SO2,常向燃煤中加入CaCO3浆状物进行脱硫,脱硫的产物用于制造石膏。脱硫反应的化学方程式为____。
②某兴趣小组对取得的酸雨样品进行pH测定,随着的简的推移,得到以下数据(pH越小,酸性越强)。
时间/h | 开始 | 8 | 16 | 24 | 32 | 40 | 48 |
pH | 5.0 | 4.8 | 4.5 | 4.3 | 4.2 | 4.0 | 4.0 |
雨水pH变化的主要原因是___(用化学方程式表示)。
③某硫酸化工厂,使用一种含杂质为25%的黄铁矿石(FeS2)为原料。若取2吨该矿石,可制得98%的浓硫酸___吨(假设生产过程中96%SO2转化为SO3)。