题目内容
【题目】常温下,将稀HCl溶液滴加到等浓度的弱碱AOH溶液中,测得混合液的pH和![]() 的关系如图所示,其中a点表示未加盐酸时的数据,e点表示HCl和AOH恰好完全反应时的数据。下列说法错误的是( )
的关系如图所示,其中a点表示未加盐酸时的数据,e点表示HCl和AOH恰好完全反应时的数据。下列说法错误的是( )
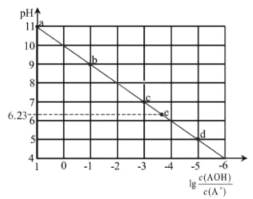
A.常温下,A+的水解平衡常数为1.0×10-10
B.点d溶液中:c(Cl-)> c(AOH)>c(A+)
C.点c 溶液中的n(A+)+n(AOH)等于点e溶液中的n(Cl-)
D.点e溶液中水电离出的H+浓度为10-6.23 mol/L
【答案】B
【解析】
根据![]() 与pH间关系解题,注意利用图中特殊的点,
与pH间关系解题,注意利用图中特殊的点,![]() =0时,
=0时,![]() =1;c点pH=7,结合电荷守恒分析;e点表示HCl和AOH恰好完全反应,根据物料守恒有n(A+)+n(AOH)=n(Cl-),又已知e点溶液的pH=6.23,c(H+)=10-6.23mol·L-1;d点
=1;c点pH=7,结合电荷守恒分析;e点表示HCl和AOH恰好完全反应,根据物料守恒有n(A+)+n(AOH)=n(Cl-),又已知e点溶液的pH=6.23,c(H+)=10-6.23mol·L-1;d点![]() =-5,c(AOH)的浓度非常小,c(A+)>c(AOH)。
=-5,c(AOH)的浓度非常小,c(A+)>c(AOH)。
A.根据图象可知,![]() =0时,
=0时,![]() =1,溶液的pH=10,c(H+)=1.0×10-10mol·L-1,则A+的水解平衡常数Kh=
=1,溶液的pH=10,c(H+)=1.0×10-10mol·L-1,则A+的水解平衡常数Kh=![]() =c(H+)=1.0×10-10,故A正确;
=c(H+)=1.0×10-10,故A正确;
B.d点![]() =-5,c(AOH)的浓度非常小,c(A+)>c(AOH);此时溶液的pH=5,溶液呈酸性,则c(OH-)<c(H+),结合电荷守恒可知c(Cl-)>c(A+),正确的离子浓度大小为c(Cl-)>c(A+)>c(AOH),故B错误;
=-5,c(AOH)的浓度非常小,c(A+)>c(AOH);此时溶液的pH=5,溶液呈酸性,则c(OH-)<c(H+),结合电荷守恒可知c(Cl-)>c(A+),正确的离子浓度大小为c(Cl-)>c(A+)>c(AOH),故B错误;
C.e点表示HCl和AOH恰好完全反应,根据物料守恒:n(A+)+n(AOH)=n(Cl-),A的各种存在形态总和,c点和e点相同,故C正确;
D.弱碱AOH溶液中滴入HCl,溶液碱性逐渐减弱,e点溶液的pH=6.23,c(H+)=10-6.23mol·L-1,该点HCl和AOH恰好完全反应,A+水解促进了水电离,溶液中氢离子是水电离的,则水电离的c(H+)=10-6.23mol·L-1,故D正确;
故选B。

 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案【题目】某化学兴趣小组要完成中和热的测定实验。
(1)实验桌上备有大、小两个烧杯、泡沫塑料、泡沫塑料板、胶头滴管、量筒、0.5 mol·L-1盐酸、0.55 mol·L-1氢氧化钠溶液,实验尚缺少的玻璃用品是___、___。
(2)他们记录的实验数据如下:
实验用品 | 溶液温度 | 中和热 | |||
t1 | t2 | ΔH | |||
a | 50mL 0.55mol·L-1NaOH溶液 | 50mL0.5mol·L-1HCl溶液 | 20℃ | 23.3℃ | ___ |
b | 50 mL0.55mol·L-1 NaOH溶液 | 50mL0.5mol·L-1 HCl溶液 | 20℃ | 23.5℃ | |
已知:反应后溶液的比热容c为4.18 kJ·℃-1·kg-1,各物质的密度均为1g·cm-3。计算完成表中ΔH=___。
(3)___(填“能”或“不能”)用Ba(OH)2溶液和硫酸代替氢氧化钠溶液和盐酸。
【题目】下列方程式属于水解反应方程式的是( )
A.H2CO3![]() HCO3-+H+B.HCO3-+H2O
HCO3-+H+B.HCO3-+H2O![]() H3O++CO32-
H3O++CO32-
C.HCO3-+OH-=H2O+CO32-D.CO32-+H2O![]() HCO3-+OH-
HCO3-+OH-
【题目】I.为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学们分别设计了如图甲、乙所示的实验装置。请回答相关问题:

(1)定性甲所示装置可通过观察___,定性比较得出结论。有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是___。
(2)定量如图乙所示,实验时均以生成40mL气体为准,其他可能影响实验的因素均已忽略。图中仪器A的名称为___,实验中需要测量的数据是___。
Ⅱ.以下是某研究小组探究影响反应速率部分因素的相关实验数据。
实验序号 | H2O2溶液浓度/% | H2O2溶液体积/mL | 温度/℃ | MnO2的用量/g | 收集O2的体积/mL | 反应所需时间/s |
① | 5 | 1 | 20 | 0.1 | 4 | 16.75 |
② | 15 | 1 | 20 | 0.1 | 4 | 6.04 |
③ | 30 | 5 | 35 | 2 | 49.21 | |
④ | 30 | 5 | 55 | 2 | 10.76 |
(1)写出实验①中H2O2分解的化学方程式___。
(2)通过实验①和②对比可知,化学反应速率与____有关;从实验③和④对比可知,化学反应速率与温度的关系是___。