题目内容
16.下列表示离子化合物形成过程的电子式正确的是( )| A. | 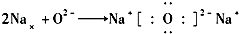 | B. | 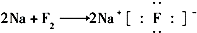 | ||
| C. | 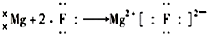 | D. | 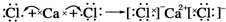 |
分析 A.过氧根离子应该写成两个氧原子的形式;
B.用电子式表示氟化钠的形成过程时,左边需要用原子及最外层电子表示,不能写成原子或分子;
C.MgF2电子式中2个氟离子在镁离子两边;
D.氯化钙属于离子化合物,阴阳离子需要标出所带电荷,阴离子还需要表示出最外层电子.
解答 解:A.该式子中左边不能写成过氧根离子形式,用电子式表示过氧化钠的形成过程为: ,故A错误;
,故A错误;
B.NaF为离子化合物,用电子式表示的形成过程为: ,故B错误;
,故B错误;
C.氟离子和镁离子通过离子键形成离子化合物氟化镁,其正确的形成过程为: ,故C错误;
,故C错误;
D.氯化钙为离子化合物,用电子式表示其形成过程为: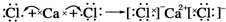 ,故D正确;
,故D正确;
故选D.
点评 本题考查了用电子式表示化合物形成过程,题目难度中等,要求学生熟练掌握电子式的概念及表示方法,能够用电子式正确表示离子化合物、共价化合物的形成过程.

练习册系列答案
 口算能手系列答案
口算能手系列答案
相关题目
6.乙烷与氯气在光照条件先发生取代反应所得有机产物数目共有( )
| A. | 7种 | B. | 8种 | C. | 9种 | D. | 10种 |
7.元素周期表是化学学习和科学研究的重要工具,下列对于元素周期表的使用方法不正确的是( )
| A. | 为新元素的发现及预测它们的原子结构和性质提供线索 | |
| B. | 利用元素周期表发现元素的种类和原子的种类相同 | |
| C. | 在周期表中金属与非金属的分界处,可寻找半导体材料 | |
| D. | 指导人们在过渡元素中寻找催化剂和耐高温.耐腐蚀的合金材料 |
4.下列各指定微粒的数目比不是1:1的是( )
| A. | Na2O2中阴离子和阳离子 | B. | NaOH晶体中阳离子和阴离子 | ||
| C. | ${\;}_{12}^{24}$Mg2+离子中的质子和中子 | D. | 氯化钠中的质子总数和电子总数 |
11.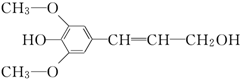 膳食纤维具有突出的保健功能,是人体的“第七营养素”.木质素是一种非糖类膳食纤维.其单体之一是芥子醇,结构简式如图所示.下列有关芥子醇的说法正确的是( )
膳食纤维具有突出的保健功能,是人体的“第七营养素”.木质素是一种非糖类膳食纤维.其单体之一是芥子醇,结构简式如图所示.下列有关芥子醇的说法正确的是( )
 膳食纤维具有突出的保健功能,是人体的“第七营养素”.木质素是一种非糖类膳食纤维.其单体之一是芥子醇,结构简式如图所示.下列有关芥子醇的说法正确的是( )
膳食纤维具有突出的保健功能,是人体的“第七营养素”.木质素是一种非糖类膳食纤维.其单体之一是芥子醇,结构简式如图所示.下列有关芥子醇的说法正确的是( )| A. | 芥子醇的分子式是C11H14O4,属于芳香烃 | |
| B. | 芥子醇分子中所有碳原子不可能在同一平面上 | |
| C. | 芥子醇不能使酸性KMnO4溶液褪色 | |
| D. | 芥子醇可以发生氧化反应、取代反应、加成反应 |
15.CuCl2常用于颜料、木材防腐等工业,并用作消毒剂、媒染剂、催化剂.工业上用粗制的氧化铜粉末(含FeO和SiO2杂质)来制取无色CuCl2的流程如下: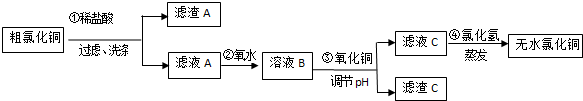
已知:Fe3+、Fe2+、Cu2+转化为相应的氢氧化物,开始沉淀和沉淀完全时的pH如下表
(1)第②步反应的离子方程式为2Fe2++Cl2=2Fe3++2Cl-.
(2)滤渣A的成分有SiO2(填化学式),检验滤液C中的Fe3+离子是否除尽的方法是取少量滤液C于试管中,向其中加入硫氰化钾溶液,溶液变血红色,证明滤液C中Fe3+未除尽,反之未除尽.
(3)第④步蒸发操作必要的仪器有铁架台(含铁圈)、坩埚钳、石棉网、酒精灯、蒸发皿、玻璃棒,需要在氯化氢气流中蒸干制取无水氯化铜的原因是氯化氢可抑制氯化铜的水解;
(4)称取30.250g已制得的无水CuCl2产品(含0.0204molFeCl3杂质),溶于水中,加入过量的铁粉充分反应后过滤.得250mL滤液,量取25.00mL滤液于锥形瓶中,用0.100mol•L-1酸性KMnO4溶液滴定至终点,消耗KMnO4溶液体积平均为46.00mL,则该无水CuCl2产品中CuCl2的质量分数为0.89(用小数表示,计算结果保留2位小数).

已知:Fe3+、Fe2+、Cu2+转化为相应的氢氧化物,开始沉淀和沉淀完全时的pH如下表
| 离子符号 | Fe3+ | Fe2+ | Cu2+ |
| 氢氧化物开始沉淀时的pH | 2.5 | 7.0 | 4.7 |
| 氢氧化物完全沉淀时的pH | 3.2 | 9.7 | 6.7 |
(2)滤渣A的成分有SiO2(填化学式),检验滤液C中的Fe3+离子是否除尽的方法是取少量滤液C于试管中,向其中加入硫氰化钾溶液,溶液变血红色,证明滤液C中Fe3+未除尽,反之未除尽.
(3)第④步蒸发操作必要的仪器有铁架台(含铁圈)、坩埚钳、石棉网、酒精灯、蒸发皿、玻璃棒,需要在氯化氢气流中蒸干制取无水氯化铜的原因是氯化氢可抑制氯化铜的水解;
(4)称取30.250g已制得的无水CuCl2产品(含0.0204molFeCl3杂质),溶于水中,加入过量的铁粉充分反应后过滤.得250mL滤液,量取25.00mL滤液于锥形瓶中,用0.100mol•L-1酸性KMnO4溶液滴定至终点,消耗KMnO4溶液体积平均为46.00mL,则该无水CuCl2产品中CuCl2的质量分数为0.89(用小数表示,计算结果保留2位小数).
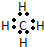 ,CaCl2
,CaCl2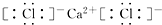 ,NaOH
,NaOH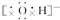 Na2O2
Na2O2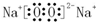 .
.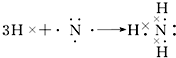 ;
; .
.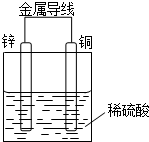 某同学设计出如下原电池原理和实验装置来证明Cu和Zn的金属活动性顺序.请你完成下列实验报告
某同学设计出如下原电池原理和实验装置来证明Cu和Zn的金属活动性顺序.请你完成下列实验报告