题目内容
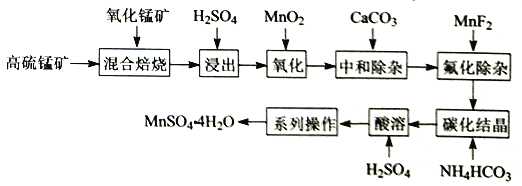
【题目】某化学小组研究在其他条件不变时,改变密闭容器中某一条件对A2(g)+3B2(g)![]() 2AB3(g) 化学平衡状态的影响,得到如下图所示的曲线(图中T表示温度,n表示物质的量)。下列判断正确的是( )
2AB3(g) 化学平衡状态的影响,得到如下图所示的曲线(图中T表示温度,n表示物质的量)。下列判断正确的是( )
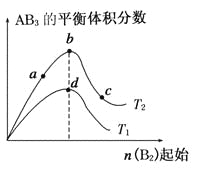
A. 在T2和n(A2)不变时达到平衡,AB3的物质的量大小 为:c>b>a
B. 若T2>T1,则正反应一定是放热反应
C. 达到平衡时A2的转化率大小为:b>a>c
D. 若T2>T1,达到平衡时b、d点的反应速率为vd>vb
【答案】D
【解析】
试题温度越高速率越快,温度T2>T1,达到平衡时b、d点的反应速率为vd<vb,A错误;若T2>T1,由图象可知温度升高AB3的物质的量增大,说明升高温度平衡向正反应方向移动,则正反应为吸热反应,B错误;由图可知,横坐标为B2的物质的量,增大一种反应物的量会促进另一种反应物的转化率增大,则B2越大达到平衡时A2的转化率越大,即达到平衡时A2的转化率大小为c>b>a,C错误;由图可知,横坐标为B2的物质的量,增大一种反应物的量必然会促进另一种反应物的转化,则B2越大达到平衡时A2的转化率越大,生成物的物质的量越大,则平衡时AB3的物质的量大小为:c>b>a,D正确;选D。

 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案【题目】在1L恒容密闭容器中充入X(g)和Y(g),发生反应X(g)+Y(g) ![]() M(g)+N(g),所得实验数据如下表,下列说法不正确的是
M(g)+N(g),所得实验数据如下表,下列说法不正确的是
实验编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | |
n(X) | n(Y) | n(M) | ||
① | 700 | 0.10 | 0.10 | 0.09 |
② | 800 | 0.20 | 0.20 | 0.10 |
③ | 900 | 0.10 | 0.15 | a |
A. 正反应为放热反应
B. 实验①中,若5min时测得n(M)=0.05mol,则0~5min时间内,用N表示的平均反应速率v(N)= 0.01mol/(Lmin)
C. 实验②中,该反应的平衡常数K=1.0
D. 实验③中,达到平衡时,a大于0.06