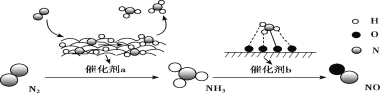
题目内容
【题目】在标准状况下四种气体:
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
(1)质量由大到小的顺序为____________。
(2)气体密度由大到小的顺序为____________。
【答案】![]()
![]()
【解析】
(1)A. ![]() 的物质的量=11.2L÷22.4L/mol=0.5mol ,质量为0.5mol×71 g/mol =35.5g ;
的物质的量=11.2L÷22.4L/mol=0.5mol ,质量为0.5mol×71 g/mol =35.5g ;
B. ![]() 的质量为0.25mol×36.5 g/mol =9.125g ;
的质量为0.25mol×36.5 g/mol =9.125g ;
C. ![]() 的质量是4.4g;
的质量是4.4g;
D. ![]() 的质量是5.1g;
的质量是5.1g;
因此,质量由大到小的顺序为![]()
答案为:![]()
(2)据PV=nRT,则P![]() =
=![]() RT,变形可得PM=ρRT,可知在标注状况下气体的密度与摩尔质量成正比,A. 氯气的摩尔质量为71g/mol; B. 氯化氢的摩尔质量为36.5g/mol; C. 一氧化二氮的摩尔质量为44g/mol;D. 氨气的摩尔质量为17g/mol。
RT,变形可得PM=ρRT,可知在标注状况下气体的密度与摩尔质量成正比,A. 氯气的摩尔质量为71g/mol; B. 氯化氢的摩尔质量为36.5g/mol; C. 一氧化二氮的摩尔质量为44g/mol;D. 氨气的摩尔质量为17g/mol。
则气体密度由大到小的顺序为![]() 。
。
答案为:![]() 。
。

练习册系列答案
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案
相关题目