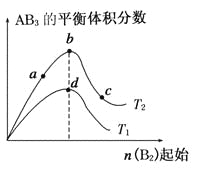
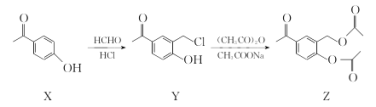
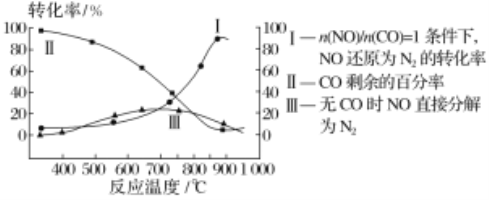
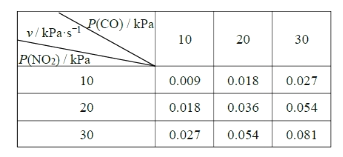
��Ŀ����
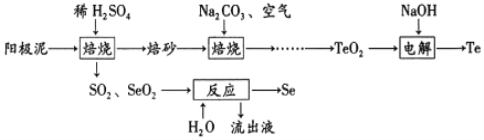
����Ŀ��п�̸ɵ�صĸ�������Ϊ��ؿ���Ľ���п�������DZ��������̺�̼�۰�Χ��ʯī�缫����������Ȼ�п���Ȼ�淋ĺ�״��õ�طŵ�����в��� MnOOH���Ͼɵ���е�Zn��MnԪ�صĻ��գ��Ի�����������Ҫ�����塣
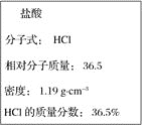
��. ����пԪ�أ��Ʊ�ZnCl2
����һ�����ȥ���弰ʯī�缫�ĺ�ɫ��״���м�ˮ�����裬����ܽ⣬�����˷���ù������Һ��
�������������Һ���õ�ZnCl2��xH2O���塣
����������SOCl2��ZnCl2��xH2O��������ȡ��ˮZnCl2��
��ȡ��ˮZnCl2������ʣ���SOCl2����֤�������к���SO2(�гּ�����װ����) ��װ�����£�
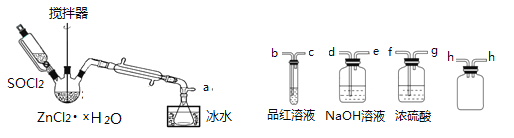
(��֪�� SOCl2��һ�ֳ��õ���ˮ�����۵㣭105�棬�е�79�棬140������ʱ�ֽ⣬��ˮ����ˮ�������������塣)
��1��д��SOCl2��ˮ��Ӧ�Ļ�ѧ����ʽ��______________________��
��2���ӿڵ�����˳��Ϊa��___��___�� h �� h ��___��___��___��e��______________
��. ������Ԫ�أ��Ʊ�MnO2
��3��ϴ�Ӳ���һ�õ��Ĺ��壬�жϹ���ϴ�Ӹɾ��ķ�����_________________________��
��4��ϴ�Ӻ�Ĺ��徭�������ɺ�������գ����յ�Ŀ��__________________________��
��. �������̴��ȵIJⶨ
��ȡ1.40g���պ�IJ�Ʒ������2.68g�����ƣ�Na2C2O4�����壬�ټ���������ϡ���Ტ���ȣ����ʲ����뷴Ӧ������ַ�Ӧ����ȴ����������Һת�Ƶ�100mL����ƿ��������ˮϡ�������ߣ�����ȡ��20.00mL����0.0200mol/L���������Һ���еζ����ζ����Σ����ĸ��������Һ�����ƽ��ֵΪ17.30mL��
��5��д��MnO2�ܽⷴӦ�����ӷ���__________________________________________��
��6����Ʒ�Ĵ���Ϊ______________________ ��
��7�������ղ���֣��ζ�ʱ���ĸ��������Һ���_____������ƫ�������� ƫС������ ����������
���𰸡�SOCl2+H2O=SO2��+2HCl�� f �� g �� h �� h �� b �� c �� d �� e ȡ���һ��ϴҺ���μ�AgNO3��Һ�����ް�ɫ�������ɣ���˵������ϴ�Ӹɾ� ��ȥ̼�ۣ�����MnOOH����ΪMnO2 MnO2+C2O42-+4H+=Mn2++2CO2��+ 2H2O 97.4% ƫ��
��������
��.��1��SOCl2��ˮ��Ӧ����SO2��HCl��SOCl2+H2O=SO2��+2HCl����
��2������ƿ��SOCl2���սᾧˮ�õ�SO2��HCl���ñ�ˮ��ȴ�ռ�SOCl2��Ũ��������ˮ��������ֹ��Һ��ˮ����������ƿ�У���Ʒ����Һ�����������������������Һ����β���ֶ���������HCl����ֹ��Ⱦ������hװ�÷�ֹ������
��.��3��ϴ�Ӳ���һ�õ��Ĺ��壬�жϹ���ϴ�Ӹɾ��ķ����Ǽ���ϴ��Һ����û�������ӣ�
��4��ϴ�Ӻ�Ĺ��徭�������ɺ�������գ����ճ�ȥ���ڶ��������е�̼������MnOOH����ΪMnO2��
��. ��5��MnO2��C2O42����H��������������CO2����+4���̻�ԭ��Mn2����
��6��n��C2O42����=2.68g��134g��mol��1=0.02mol���ζ�100mLϡ�ͺ���Һ������n��MnO4����=0.0200mol��L��1��0.01730L��5=0.001730mol������������ԭ��Ӧ�е�ʧ��������ȵ�n��MnO2����2+0.001730mol��5=0.0200mol��2��n��MnO2��=0.015675mol���ٸ�������������ʽ����������������
��7�������ղ���֣�����Ҳ�����ĸ�����أ��ζ�ʱ���ĸ��������Һ�����ƫ��
��.��1��SOCl2��ˮ��Ӧ����SO2��HCl����Ӧ����ʽΪ��SOCl2+H2O=SO2��+2HCl��
��2������ƿ��SOCl2���սᾧˮ�õ�SO2��HCl���ñ�ˮ��ȴ�ռ�SOCl2��Ũ��������ˮ��������ֹ��Һ��ˮ����������ƿ�У���Ʒ����Һ�����������������������Һ����β���ֶ���������HCl����ֹ��Ⱦ������hװ�÷�ֹ�������ӿڵ�����˳��Ϊa�� f �� g �� h �� h �� b �� c �� d �� e ��
��.��3��ϴ�Ӳ���һ�õ��Ĺ��壬�жϹ���ϴ�Ӹɾ��ķ����Ǽ���ϴ��Һ����û�������ӣ�ȡ���һ��ϴҺ���μ�AgNO3��Һ�����ް�ɫ�������ɣ���˵������ϴ�Ӹɾ���
��4��ϴ�Ӻ�Ĺ��徭�������ɺ�������գ����ճ�ȥ���ڶ��������е�̼������MnOOH����ΪMnO2��
��. ��5��MnO2��C2O42����H��������������CO2��+4���̻�ԭ��Mn2����MnO2�ܽⷴӦ�����ӷ���MnO2+C2O42-+4H+=Mn2++2CO2��+ 2H2O��
��6��n��C2O42����=2.68g��134g��mol��1=0.02mol���ζ�100mLϡ�ͺ���Һ������n��MnO4����=0.0200mol��L��1��0.01730L��5=0.001730mol������������ԭ��Ӧ�е�ʧ��������ȵ�n��MnO2����2+0.001730mol��5=0.0200mol��2��n��MnO2��=0.015675mol������������������=0.015675mol��87g��mol��1/1.40g = 0.974����97.4%��
��7�������ղ���֣�����Ҳ�����ĸ�����أ��ζ�ʱ���ĸ��������Һ�����ƫ��

 Ӯ�ڿ�����ʦ��ʱ�ƻ�ϵ�д�
Ӯ�ڿ�����ʦ��ʱ�ƻ�ϵ�д� �������Ͽ�ʱͬ��ѵ��ϵ�д�
�������Ͽ�ʱͬ��ѵ��ϵ�д�����Ŀ���Ը���ұ���̻�(��Ҫ�ɷ�Ϊͭп���Ȼ������������Σ�������Ԫ�غ���Ԫ��)Ϊԭ�ϣ��ɻ����Ʊ�Cu��ZnSO4H2O������Ҫʵ���������£�
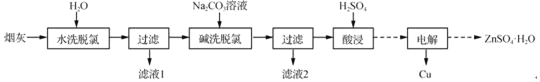
��֪����Fe3+��ȫ����pHΪ3.2����ʱZn2+��Cu2+δ��ʼ������
��K3[Fe(CN)6]�����ڼ���Fe2+��3Fe2++2[Fe(CN)6]3���TFe3[Fe(CN)6]2��(����ɫ)��
����Ԫ�ؽ���ˮ���жԻ�����Ⱦ��ͨ����������ȥ��
(1)�������Ⱦ�����85�������½��У����˵ļ��ȷ�ʽΪ_____��
(2)��ϴ����ʱ����Һ��Cu2+��Ҫת��ΪCu(OH)2��Cu2(OH)2CO3��Ҳ�ᷢ������Ӧ�õ�Cu2(OH)3Cl�������ų����壬�ø���Ӧ�����ӷ���ʽΪ_____������NaOH��Һ���м�ϴ����ʱ��Ũ�Ȳ��˹���ͨ���±������ݷ�����ԭ����_____��
NaOH��ҺŨ�ȶ������ʺ�����Ԫ�ؽ����ʵ�Ӱ��
NaOHŨ��/molL��1 | ������/% | Ԫ�ؽ�����/% | ||
Cl | Zn | Cu | As | |
1.0 | 51.20 | 0.51 | 0.04 | 0.00 |
2.0 | 80.25 | 0.89 | 0.06 | 58.87 |
3.0 | 86.58 | 7.39 | 0.26 | 78.22 |
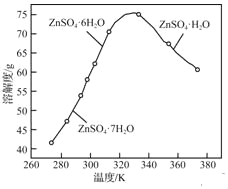
(3)ZnSO4���ܽ����������ͼ��ʾ�������������Һ�л���ZnSO4H2O��ʵ�顢����Ϊ_____��
(4)��Һ1����Һ2�к�һ������Cu2+��Zn2+��Ϊ���ԭ�������ʣ��ɲ�ȡ�Ĵ�ʩ�У�����Һ1����Һ2��ϣ�����ͭп�����ѭ��ʹ�õ����̲�����_____(�ѧʽ)��
(5)��֪H3AsO3�Ļ�ԭ��ǿ��Fe2+��Ksp(FeAsO3)��Ksp(FeAsO4)��5.7��10��21��������Һ��������Ԫ��(��Fe2+����