题目内容
【化学――选修化学与技术】(15分)
氨在国民经济中占有重要地位,下图是合成氨的简要流程:

I.原料气的制备:
(1) 合成氨所需氮气来自空气,方法之一是将空气液化后再加热分馆;请另设计一种从空气中分离出氮气的方法:_________________________________________________________;
(2) 请写出工业上获得氢气的一种方法(用化学方程式表示)____________
II.原料气的净化:、
为防止催化剂“中毒”,原料气在进人压缩机之前必须经过净化、精制处理,“精制”过程通常是将含有少量CO、CO2、O2和H2S等杂质的原料气体通入含有氨水的醋酸亚铜二氨( )溶液,以获得纯净原料气。其中,吸收CO的反应为:
)溶液,以获得纯净原料气。其中,吸收CO的反应为:

(3) 为提髙CO吸收率,可采取的有效措施是__________________
(4) 除去氧气时,氧气将 氧化为
氧化为 ,则反应中还原剂与氧化剂的物质的量之比是____________;
,则反应中还原剂与氧化剂的物质的量之比是____________;

III.氨的合成:
(5)据报道,科学家采用高质子导电性的SCY陶瓷(能传递H+)为介质,用吸附在它内外表面上的金属钯多晶薄膜做电极,实现了髙温常压下高转化率的电化学合成氨。其实验装置如图。请写出钯电极A上的电极反应式________________________
(1)让碳在空气中燃烧,使氧气耗尽,再通过碱液除去CO2可得到氮气。
(2) C+H2O CO+H2或者CO+H2O
CO+H2或者CO+H2O CO2+H2或者CH4
CO2+H2或者CH4 C+2H2 或者CH4+H2O
C+2H2 或者CH4+H2O  CO +3H2
CO +3H2
(3)降温、加压(4) 4:1。(5) N2+6e-+6H+=2NH3。
【解析】本题考查合成氨的有关知识。(1) 空气主要是氧气和氮气的混合物,可以采用化学方法除去氧气,得到氮气,方法是让碳在空气中燃烧,使氧气耗尽,再通过碱液除去CO2可得到氮气。
(2) 氢气可通过将水蒸气通过灼热的碳层得到氢气,方程式为C+H2O CO+H2或者CO+H2O
CO+H2或者CO+H2O CO2+H2,另外通过甲烷的高温分解得到CH4
CO2+H2,另外通过甲烷的高温分解得到CH4 C+2H2或者甲烷和高温水蒸气反应得到,CH4+H2O
C+2H2或者甲烷和高温水蒸气反应得到,CH4+H2O  CO +3H2。
CO +3H2。
(3) 吸收CO的可逆反应正反应是体积缩小、放热反应,因此可以采用降温和加压的方法来提高吸收CO的效率。
(4) 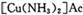 中的Cu显+1价,
中的Cu显+1价,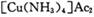 中的Cu显+2价,而1omlO2要得到4oml电子,根据得失电子数守恒,反应中还原剂与氧化剂的物质的量之比4:1。
中的Cu显+2价,而1omlO2要得到4oml电子,根据得失电子数守恒,反应中还原剂与氧化剂的物质的量之比4:1。
(5) 从实验装置如图可以看出,电化学合成氨是通电合成,A电极是N2得到电子,发生还原反应,电极反应式为N2+6e-+6H+=2NH3。

 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案下图是某工厂对海水资源进行综合利用的示意图.
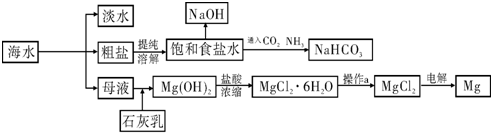
请回答下列问题:
(1)请列举一种海水淡化的方法
(2)工业上常用离子交换膜电解槽生产NaOH,电解过程中大量通过离子交换膜的离子是
(3)侯氏制碱法中首先向饱和食盐水中通入CO2和NH3制得NaHCO3,先通入
(填化学式),理由是
(4)镁是一种用途很广泛的金属材料,目前世界上60%的镁从海水中提取.已知有关物质的熔沸点数据如下:
| MgO | MgCl2 | |
| 熔点/℃ | 2852 | 714 |
| 沸点/℃ | 3600 | 1412 |
 2NH3↑+CaCl2+2H2O
2NH3↑+CaCl2+2H2O Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O