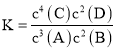题目内容
【题目】据报道,科学家已成功合成了少量N4,有关N4的说法正确的是( )
A.N4与N2化学性质相似
B.N4与N2互为同位素
C.相同质量的N4和N2含原子个数比为1:1
D.N4的摩尔质量是56g
【答案】AC
【解析】
有相同质子数,不同中子数的原子或同一元素的不同核素互为同位素,同种元素形成的不同单质互称同素异形体。
A.N4与N2是N元素形成的不同单质,互为同素异形体,同素异形体的化学性质相似,故A正确;
B.N4与N2是N元素形成的不同单质,互为同素异形体,故B错误;
C.相同质量的N4和N2的物质的量之比为n(N4):n(N2)=![]() :
:![]() =
=![]() =1:2,则原子个数比为1:1,故C正确;
=1:2,则原子个数比为1:1,故C正确;
D.摩尔质量的单位是g·mol-1,故D错误;
答案选AC。

 红果子三级测试卷系列答案
红果子三级测试卷系列答案 课堂练加测系列答案
课堂练加测系列答案【题目】工业上在恒容密闭容器中用下列反应合成甲醇:CO(g)+2H2(g)![]() CH3OH(g)ΔH=akJ/mol下,表所列数据是反应在不同温度下的化学平衡常数(Kc)。
CH3OH(g)ΔH=akJ/mol下,表所列数据是反应在不同温度下的化学平衡常数(Kc)。
温度 | 250℃ | 300℃ | 350℃ |
K | 2.0 | 0.27 | 0.012 |
(1)写出该反应的压强平衡常数的表达式Kp______。
(2)判断该反应达到平衡状态的依据有_________。
A.消耗CH3OH的速率与消耗CO的速率相等 B.混合气体的平均相对分子质量不变
C.混合气体的密度不变 D.容器内气压不变
(3)根据上表数据,要同时提高CO的平衡转化率和反应速率,可采取的措施是______。
A.升温 B.充入H2 C.分离出甲醇 D.加入催化剂
(4)250℃时,将2 mol CO和一定量的H2充入2 L的密闭容器中,充分反应10min后,达到平衡时测得c(CO)=0.2mol·L-1,则以H2表示的反应速率v(H2)=_____。平衡后再向容器中加入0.1 mol CO和 0.4 mol CH3OH,则此时v正___v逆(填“>”、“<”或“=”)。
(5)CO还可以用做燃料电池的燃料。若电池用Li2CO3和Na2CO3的熔融盐混合物作电解质,CO为负极燃气,空气与CO2的混和气为正极助燃气,电池在650 ℃下工作时,其正极反应式:O2+ 2CO2 + 4e-=2CO32-,则负极反应式为:________。
【题目】下列实验操作、现象及结论均正确的是 ( )
选项 | 实验操作 | 实验现象 | 实验结论 |
A | 将盛有等物质的量的氯气和甲烷的硬质大试管放在光亮处 | 试管内气体颜色变浅,试管壁出现油状液滴,试管中有少量白雾 | 甲烷和氯气发生了加成反应 |
B | 向葡萄糖溶液中滴加新制的氢氧化铜溶液,小火加热 | 有砖红色沉淀生成 | 葡萄糖中含有醛基 |
C | 向 | 产生有香味的液体,沉在饱和碳酸钠溶液底部 | 有乙酸乙酯生成 |
D | 将苯与液溴的混合物装入洁净试管中,振荡一段时间后,将混合物倒入盛有水的烧杯中 | 烧杯底部有油状液体 | 苯与液溴发生了取代反应,溴苯难溶于水,密度比水大 |
A.AB.BC.CD.D