题目内容
6.已知25℃时,BaCO3的溶度积Ksp=2.58×10-9,BaSO4的溶度积Ksp=1.07×10-10,则下列说法不正确的是( )| A. | 温度一定时,当溶液中c(Ba2+)×c(SO42-)=1.07×10-10时,此溶液为BaSO4的饱和溶液 | |
| B. | 因为Ksp(BaCO3)>Ksp(BaSO4),所以无法将BaSO4转化为BaCO3 | |
| C. | 25℃时,在未溶解完BaCO3的饱和溶液中滴入少量Na2SO4溶液后有BaSO4沉淀析出,此时溶液中c(CO32-):c(SO42-)=24.11 | |
| D. | 在饱和BaCO3溶液中加入少量Na2CO3固体,可使c(Ba2+)减小,BaCO3的溶度积不变 |
分析 A.溶液中c(Ba2+)•c(SO42-)≥Ksp,即是饱和溶液;
B.当Qc=c(CO32-)•c(Ba2+)≥Ksp(BaCO3),就能转化为BaCO3;
C.根据Ksp(BaSO4 和Ksp(BaCO3)计算可求出;
D.溶度积只与温度有关,碳酸根离子浓度增大,则钡离子浓度减小.
解答 解:A.c(Ba2+)•c(SO42-)=Ksp,即是饱和溶液,所以当溶液中Ksp=c(Ba2+)•c(SO42-)=1.07×10-10时,此溶液为BaSO4的饱和溶液,故A正确;
B.当Qc=c(CO32-)•c(Ba2+)≥Ksp(BaCO3),就能转化为BaCO3,所以当c(CO32-)足够大时,满足Qc=c(CO32-)•c(Ba2+)≥Ksp(BaCO3),则BaSO4能转化为BaCO3,故B错误;
C.根据Ksp(BaSO4)和Ksp(BaCO3)表达式可知:c(CO32-):c(SO42-)=$\frac{{K}_{sp}(BaC{O}_{3})}{{K}_{sp}(BaS{O}_{4})}$=$\frac{2.58×1{0}^{-9}}{1.07×1{0}^{-10}}$=24.11,故C正确;
D.溶度积只与温度有关,所以在饱和BaCO3溶液中加入少量Na2CO3固体,可使c(Ba2+)减小,但BaCO3的溶度积不变,故D正确;
故选B.
点评 本题考查了难溶物溶解平衡及沉淀转化的本质,题目难度中等,注意掌握沉淀溶解平衡及其影响,明确Ksp的大小与溶解度的关系,试题侧重考查学生的分析、理解能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
16.如表是元素周期表的一部分,针对表中的①~⑥元素,回答下列问题
(1)最活泼的金属元素是Na(填元素符号),②和⑤两种元素原子半径较大的是Si(填元素符号),⑤和⑥两种元素最高价氧化物对应的水合物酸性较强的元素是Cl(填元素符号);
(2)写出①单质在⑥单质中燃烧的化学方程式H2+Cl2$\frac{\underline{\;点燃\;}}{\;}$2HCl.
(3)①②③三种元素能够形成多种有机化合物,其中一种不仅是厨房调味剂而且还能除去水垢.写出此物质的结构式:CH3COOH;写出该物质与NaHCO3反应的化学方程式:CH3COOH+NaHCO3→CH3COONa+H2O+CO2↑.
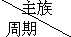 | ⅠA | 0族 | ||||||
| 一 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 二 | ② | ③ | ||||||
| 三 | ④ | ⑤ | ⑥ | |||||
(2)写出①单质在⑥单质中燃烧的化学方程式H2+Cl2$\frac{\underline{\;点燃\;}}{\;}$2HCl.
(3)①②③三种元素能够形成多种有机化合物,其中一种不仅是厨房调味剂而且还能除去水垢.写出此物质的结构式:CH3COOH;写出该物质与NaHCO3反应的化学方程式:CH3COOH+NaHCO3→CH3COONa+H2O+CO2↑.
14.下列化学式与其名称的对应关系正确的是( )
| A. | 软脂酸 C17H33COOH | B. | 纯碱 Na2CO3•10H2O | ||
| C. | 纤维素[C6H7O2(OH)3]n | D. | 丙氨酸 CH2(NH2)CH2COOH |
1.某烃分子中碳氢质量之比为24:5,则该烃的一氯代物中含有两个甲基的同分异构体的数目是(不考虑立体异构)( )
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
18.下列与有机物的结构、性质有关的叙述正确的是( )
| A. | 苯、油脂均不能使酸性KMnO4溶液褪色 | |
| B. | 淀粉、纤维素、油脂和蛋白质均是高分子化合物 | |
| C. | 乙酸和乙醛可用新制的Cu(OH)2悬浊液加以区别 | |
| D. | 乙醇、乙酸能与Na反应放出H2,二者分子中官能团相同 |
15. 下列两种方案制备氢氧化铝:
下列两种方案制备氢氧化铝:
Ⅰ:2.7gAl$\stackrel{100mL稀盐酸}{→}$X溶液$\stackrel{氢氧化钠溶液}{→}$氢氧化铝
Ⅱ2.7gAl$\stackrel{100mL氢氧化钠溶液}{→}$Y溶液$\stackrel{稀盐酸}{→}$氢氧化铝
已知所用的稀盐酸与氢氧化钠溶液均为3mol/L.图是向X溶液与Y溶液中分别加入氢氧化钠溶液或稀盐酸时产生沉淀的质量与加入溶液体积之间的关系.(混合后体积变化忽略不计)下列说法正确的是( )
 下列两种方案制备氢氧化铝:
下列两种方案制备氢氧化铝:Ⅰ:2.7gAl$\stackrel{100mL稀盐酸}{→}$X溶液$\stackrel{氢氧化钠溶液}{→}$氢氧化铝
Ⅱ2.7gAl$\stackrel{100mL氢氧化钠溶液}{→}$Y溶液$\stackrel{稀盐酸}{→}$氢氧化铝
已知所用的稀盐酸与氢氧化钠溶液均为3mol/L.图是向X溶液与Y溶液中分别加入氢氧化钠溶液或稀盐酸时产生沉淀的质量与加入溶液体积之间的关系.(混合后体积变化忽略不计)下列说法正确的是( )
| A. | 在a曲线表示的是向Y溶液中加入稀盐酸 | |
| B. | 方案Ⅱ比方案Ⅰ生成更多的气体 | |
| C. | 在M点时,两方案中所得溶液的溶质质量分数相同 | |
| D. | M点以后,a、b两条曲线将重合为一条 |

 .
. .
. .
. .
.