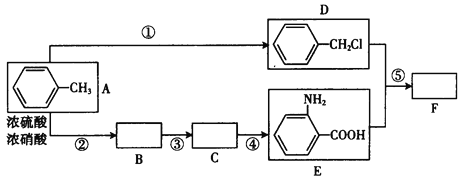
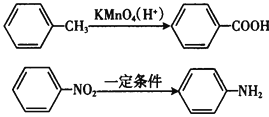
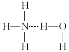题目内容
【题目】不同浓度的硫酸与锌反应时,硫酸可以被还原为SO2,也可被还原为氢气。为了验证这一事实,某同学拟用下图装置进行实验(实验时压强为10lkPa,温度为0℃)。
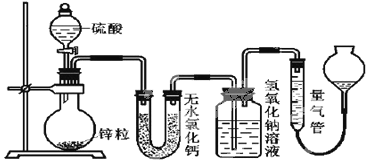
(1)若在烧瓶中放入1.30g锌粒,与cmol/LH2SO4反应,为保证实验结论的可靠,量气管的适宜规格是__。
A.200mL B.400mL C.500mL
(2)若1.30g锌粒完全溶解,氢氧化钠洗气瓶增重l.28g,则圆底烧瓶中发生反应的化学方程式为:__。
(3)若烧瓶中投入ag锌且完全反应,氢氧化钠洗气瓶增重bg。量气瓶中收集到VmL气体,则有:![]() ,依据的原理是___。
,依据的原理是___。
(4)若在烧瓶中投入dg锌,加入一定量的cmol/L浓硫酸VL,充分反应后锌有剩余,测得氢氧化钠洗气瓶增重mg,则整个实验过程产生的气体中,![]() =__(用含字母的代数式表示)。若撤走盛有无水氯化钙的U型管,
=__(用含字母的代数式表示)。若撤走盛有无水氯化钙的U型管,![]() 的数值将__(填偏大、偏小或无影响)。
的数值将__(填偏大、偏小或无影响)。
(5)反应结束后,为了准确地测量气体体积,除了待冷却至室温才开始读数外,量气管在读数时还应注意:①___;②___。
【答案】C Zn+2H2SO4(浓)=ZnSO4+SO2↑+2H2O 得失电子守恒 ![]() 偏小 读数前使量气管左右液面相平 眼睛视线与液面最低处相平
偏小 读数前使量气管左右液面相平 眼睛视线与液面最低处相平
【解析】
分析实验装置,无水氯化钙作干燥剂,干燥生成的气体。盛有氢氧化钠溶液的试剂瓶作为洗气装置,可吸收酸性气体。结合题意,可知氢氧化钠溶液吸收SO2,而量气管主要测量生成的H2的体积。根据氢氧化钠洗气瓶的重量变化和量气瓶收集到的气体的体积进行计算,分析发生的反应。
(1)假设1.30g锌与硫酸完全反应生成氢气,即发生反应:Zn+2H+=Zn2++H2↑,根据得失电子守恒,可知生成H2的体积为V=![]() ,量气管适宜规格为500mL,C项正确;答案为:C。
,量气管适宜规格为500mL,C项正确;答案为:C。
(2)若1.30g锌粒完全溶解,生成气体的总物质的量是0.02mol,氢氧化钠能吸收二氧化硫,氢氧化钠洗气瓶增重l.28g,说明反应生成二氧化硫1.28g,则二氧化硫的物质的量=![]() ,说明反应只生成SO2气体,发生的反应为:Zn+2H2SO4(浓)=ZnSO4+SO2↑+2H2O。答案为:Zn+2H2SO4(浓)=ZnSO4+SO2↑+2H2O;
,说明反应只生成SO2气体,发生的反应为:Zn+2H2SO4(浓)=ZnSO4+SO2↑+2H2O。答案为:Zn+2H2SO4(浓)=ZnSO4+SO2↑+2H2O;
(3)氢氧化钠洗气瓶增重是因为吸收SO2的缘故,说明烧瓶中有SO2的生成(Zn+2H2SO4(浓)=ZnSO4+SO2↑+2H2O),量气管中收集到气体是氢气,烧瓶中有氢气产生(Zn+2H+=Zn2++H2↑),这两个反应都是氧化还原反应,根据得失电子数目守恒有:![]() ,故依据的原理是得失电子守恒。答案为:得失电子守恒;
,故依据的原理是得失电子守恒。答案为:得失电子守恒;
(4)氢氧化钠洗气瓶增重mg,说明m(SO2)=mg,则n(SO2)=![]() ,消耗硫酸的物质的量为n(H2SO4)=2n(SO2)=
,消耗硫酸的物质的量为n(H2SO4)=2n(SO2)=![]() ,因为锌有剩余,因此有(Vc-
,因为锌有剩余,因此有(Vc-![]() )mol的硫酸和锌反应产生氢气,生成氢气的物质的量为(Vc-
)mol的硫酸和锌反应产生氢气,生成氢气的物质的量为(Vc-![]() )mol,则
)mol,则![]() =
=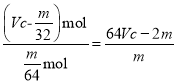 ;若撤走盛有无水氯化钙的U型管,从烧瓶中出来的水蒸气被氢氧化钠溶液吸收,m增大,则比值偏小;答案为:
;若撤走盛有无水氯化钙的U型管,从烧瓶中出来的水蒸气被氢氧化钠溶液吸收,m增大,则比值偏小;答案为:![]() ;偏小;
;偏小;
(5)因为许多反应都是放热反应,气体受温度、压强的影响,温度升高,气体受热膨胀,此时读出的气体体积偏大,因此要恢复到室温状态。为消除因压强变化导致的测量不准,可以调节量气管液面左右持平,读数时,眼睛视线与液面最低处相平,总之:①待冷却至室温才开始读数;②读数前使量气管左右液面相平;③眼睛视线与液面最低处相平。答案为:读数前使量气管左右液面相平;眼睛视线与液面最低处相平。

【题目】化学与人类生活密切相关。请按要求,回答下列问题:
(1)春秋末期工艺官书《考工记》中记载有“涑帛”的方法,即利用含有碳酸钠的水溶液来洗涤丝帛。请写出碳酸钠水溶液中通入CO2气体的化学方程式____,将54.8g Na2CO3和NaHCO3 的混合物分成等量的两份,一份溶于水后加入足量盐酸,收集到气体V L,另一份直接加热至恒重,生成气体2.24L(所有气体体积均在标准状况下测定),则原固体混合物中Na2CO3的物质的量:n(Na2CO3)=____,气体V=____。
(2)“84”消毒液在生活中使用广泛,其有效成分是次氯酸钠。可在常温下将氯气通入NaOH溶液制得,该反应的离子方程式为____,若有2mol氯气参与该反应,则此时转移的电子数为____NA。
(3)小苏打可用于治疗胃酸过多,其反应的离子方程式为____。
(4)长石是地表岩石最重要的造岩矿物。某种长石的化学组成KAlSi3O8则将其改写成氧化物的组合形式为____。
(5)葡萄糖(分子式C6H12O6)是人体活细胞的能量来源。已知1mol等于1000mmol,某体检单的一些指标如图,则每升该样品中含葡萄糖的质量为____g(请保留两位小数)。
9 | 白球比 | 1.6 | |
10 | 乳酸脱氢酶 | 161 | U/L |
11 | 磷酸肌酸激酶 | 56 | U/L |
12 | 甘油三酯 | 0.52 | mmol/L |
13 | 总胆固醇 | 4.27 | mmol/L |
14 | 高密度脂蛋白胆固醇 | 1.57 | mmol/L |
15 | 低密度脂蛋白胆固醇 | 1.40 | mmol/L |
16 | 葡萄糖 | 4.94 | mmol/L |