题目内容
从硫元素的化合价态上判断,下列物质中的硫元素不能表现氧化性的是
| A.Na2S | B.S | C.SO2 | D.H2SO4 |
A
解析试题分析:氧化性表现在得到电子,元素的化合价降低,据此可以判断。A、硫化钠中硫元素的化合价是-2价,处于最低价,因此只有还原性,A不正确;B、单质S是硫元素化合价是0价,既能表现出还原性,也能表现出氧化性,B不正确;C、SO2中硫元素的化合价是+4价,处于中间价态,既能表现出还原性,也能表现出氧化性,C不正确;D、硫酸中硫元素化合价是+6价,处于最高价,因此只有氧化性,D正确,答案选D。
考点:考查氧化性和还原性的判断

练习册系列答案
 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案
相关题目
对于Cl2+SO2+2H2O =H2SO4+2HCl反应,下列说法正确的是
①Cl2是氧化剂 ②SO2被氧化 ③Cl2被氧化 ④Cl2发生还原反应
⑤SO2具有还原性 ⑥Cl2具有氧化性
| A.只有①②⑥ | B.只有②③④ | C.只有②④⑤⑥ | D.只有①②④⑤⑥ |
下列褪色过程不是因为氧化还原反应而褪色的是( )
| A.SO2气体通入到溴水中使溴水褪色 |
| B.氯水使滴有酚酞的NaOH溶液褪色,再加入NaOH后不变红 |
| C.SO2气体能使品红溶液褪色 |
| D.在含有碘单质的淀粉溶液中,加入KOH溶液后蓝色褪去 |
过氧化氢(O为—1价)在二氧化锰催化作用下分解放出氧气的反应机理如下:
①MnO2 + H2O2 + 2H+ = Mn2+ + O2↑ + 2H2O ②Mn2+ + H2O2 = MnO2 + 2H+
下列说法正确的是( )
| A.H2O2在①中是氧化剂,在②中是还原剂 |
| B.在①中每生成1 mol O2,转移的电子数为1.204×1024 |
| C.Mn2+在①中是还原产物,在②中是氧化产物 |
| D.在二氧化锰催化作用下,1 mol H2O2分解生成22.4 L O2 |
下列转化,需要加入氧化剂才能完成的是
| A.H+ →H2 | B.MnO4-→Mn2+ | C.CO2→CO32- | D.S2-→SO42- |
下列化学反应既不属于氧化还原反应又不属于四种基本反应类型的是( )
| A.Cl2+2KBr=Br2+2KCl |
B.2NaHCO3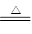 Na2CO3+H2O+CO2↑ Na2CO3+H2O+CO2↑ |
C.3O2 2O3 2O3 |
D.CH4+2O2 CO2+2H2O CO2+2H2O |
实验室可通过以下反应来制取碘:2NO+O2=2NO2;2H++2I-+NO2=NO+I2+H2O
在这一过程中,每制取l mol I2时,所消耗氧化剂的质量是( )
| A.28g | B.16g | C.329 | D.46g |
利用下列化学反应可以查出驾驶员是否酒后驾车:
2CrO3(红色)+3C2H5OH+3H2SO4=Cr2(SO4)3(绿色)+3CH3CHO+6H2O
上述反应中的氧化剂是
| A.H2SO4 | B.C2H5OH | C.Cr2(SO4)3 | D.CrO3 |
下列反应转化关系(未配平)肯定不正确的是( )
| A.S+KOH→K2SO3+K2S+H2O |
| B.FeO+HNO3→Fe(NO3)3+H2O |
| C.Cu2O+H2SO4→CuSO4+Cu+H2O |
| D.NH4NO3→N2+H2O |