题目内容
20.生活中的有机物种类丰富,在衣食住行等多方面应用广泛,其中乙醇和乙酸是比较常见的有机物.(1)工业上用乙烯与水反应可制得乙醇,该反应的化学方程式为CH2=CH3+H2O$→_{△}^{催化剂}$CH2CH2OH(不用写反应条件),原子利用率是100%.
(2)乙醇能够发生氧化反应:乙醇在铜作催化剂的条件下可被氧气氧化为乙醛,反应的化学方程式为2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O.
(3)下列关于乙醇的说法正确的是BC(选填字母).
A.乙醇不能和酸性高锰酸钾溶液发生氧化还原反应
B.交警用橙色的酸性重铬酸钾溶液检查司机是否酒后驾车
C.红葡萄酒密封储存时间越长,质量越好的原因之一是储存过程中生成了有香味的酯
(4)做菜时既加醋又加酒可以增加菜的香味,其原因是生成了酯类物质,写出该反应的化学方程式CH3COOH+CH3CH2OH$→_{△}^{浓硫酸}$CH3COOCH2CH3+H2O,该反应的反应类型为酯化反应.
分析 (1)乙烯中含双键可和水发生加成反应生成乙醇,原子利用率=(预期产物的分子量/全部生成物的分子量总和)×100%;
(2)乙醇在铜作催化剂的条件下可被氧气氧化为乙醛和水;
(3)A、乙醇可以被酸性高锰酸钾溶液氧化;
B、乙醇可以使酸性重铬酸钾溶液氧化;
C、乙醇在催化剂的催化作用下缓慢氧化为乙酸,乙酸、乙醇生成酯;
(4)醋的主要成分为CH3COOH,酒的主要成分为CH3CH2OH,二者可以发生酯化反应生成CH3COOCH2CH3.
解答 解:(1)乙烯中含双键可和水发生加成反应生成乙醇,化学方程式为CH2=CH3+H2O$→_{△}^{催化剂}$CH2CH2OH,预期产物的分子量与全部生成物的分子量总和相等,因此原子利用率100%,
故答案为:CH2=CH3+H2O$→_{△}^{催化剂}$CH2CH2OH;100%;
(2)乙醇在铜作催化剂的条件下可被氧气氧化为乙醛和水,化学方程式为2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O,故答案为:2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O;
(3)A.乙醇可以被酸性高锰酸钾溶液氧化,故A错误;
B.乙醇可以使酸性重铬酸钾溶液氧化,故B正确;
C.乙醇在催化剂的催化作用下缓慢氧化为乙酸,乙酸、乙醇反应生成乙酸乙酯,具有香味,故C正确;
故答案为:BC;
(4)醋的主要成分为CH3COOH,酒的主要成分为CH3CH2OH,二者可以发生酯化反应生成CH3COOCH2CH3,化学方程式为CH3COOH+CH3CH2OH$→_{△}^{浓硫酸}$CH3COOCH2CH3+H2O,
故答案为:CH3COOH+CH3CH2OH$→_{△}^{浓硫酸}$CH3COOCH2CH3+H2O;酯化反应.
点评 本题考查乙醇和乙酸的结构和性质,涉及乙醇的工业生产、催化氧化反应以及与乙酸发生的酯化反应等知识,掌握有机反应的断裂化学键和形成化学键的情况(反应机理)是解题的关键.

①尘埃的空气 ②酒精 ③墨水 ④稀豆浆 ⑤硫酸铜溶液.
| A. | ①②④ | B. | ①③⑤ | C. | ①③④ | D. | ②③④ |
| A. | 麦芽糖及其水解产物均能发生银镜反应 | |
| B. | 在酸性条件下,CH3CO18OC2H5的水解产物是CH3CO18OH和C2H5OH | |
| C. | 花生油既可使溴的四氯化碳溶液褪色,也可使酸性高锰酸钾溶液褪色 | |
| D. | 用甘氨酸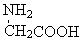 和丙氨酸 和丙氨酸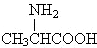 缩合最多可形成4种二肽 缩合最多可形成4种二肽 |
| 元素 | 性质 |
| A | 一种核素的原子核内不含中子 |
| B | 原子核外电子有6种不同运动状态 |
| C | 最高价氧化物的水化物与其氢化物可发生非氧化还原反应 |
| D | 单质之一为淡蓝色气体,可阻挡对人体有害的紫外线 |
| E | 周期表中位于短周期,基态原子M层成对电子数是未成对电子数的2倍 |
| F | 该元素的一种氧化物M可用作油漆颜料,与某单质反应可应用于焊接钢轨 |
(1)画出元素C的基态价电子排布图:
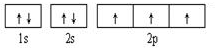 ;F元素位于周期表的d区;B、C、D三种元素的第一电离能由大到小顺序为:N>O>C(用元素符号表示).
;F元素位于周期表的d区;B、C、D三种元素的第一电离能由大到小顺序为:N>O>C(用元素符号表示).(2)化合物BA2D2蒸气293K时,理论测算密度为2.0g•L-1,实际密度为2.5g•L-1的原因是甲酸形成分子间氢键.
(3)ED2中F原子的杂化类型为sp2; ED2易溶于水的原因可能是:①②(填入序号).
①ED2与水极性相同 ②ED2可以与水反应
(4)有人推测化合物CA5的存在,该化合物中含有化学键的可能类型为:离子键、共价键.
(1)卤族元素位于周期表的p区;溴的价电子排布式为4s24p5.
(2)在不太稀的溶液中,氢氟酸是以二分子缔合(HF)2形式存在的.使氢氟酸分子缔合的作用力是氢键.
(3)请根据如表提供的第一电离能数据判断:最有可能生成较稳定的单核阳离子的卤素原子是I.
| 氟 | 氯 | 溴 | 碘 | 铍 | |
| 第一电离能(kJ/mol) | 1681 | 1251 | 1140 | 1008 | 900 |
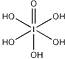 )和HIO4,前者为五元酸,后者为一元酸.请比较二者酸性强弱:H5IO6<HIO4.(填“>”、“<”或“=”)
)和HIO4,前者为五元酸,后者为一元酸.请比较二者酸性强弱:H5IO6<HIO4.(填“>”、“<”或“=”)(5)已知ClO2-为角型,中心氯原子周围有四对价层电子.ClO2-中心氯原子的杂化轨道类型为sp3
(6)写出一个ClO2-的等电子体Cl2O或OF2.
| A. | 只有金属化合物才有焰色反应 | |
| B. | 焰色反应是化学变化 | |
| C. | 透过蓝色钴玻璃观察钾元素焰色反应的颜色为紫色 | |
| D. | 每次焰色反应实验后都要将铂丝蘸取氢氧化钠溶液洗涤并灼烧 |
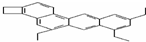 doggycene的分子式为C26H26.
doggycene的分子式为C26H26.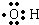 ;
;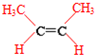 ;
;