题目内容
【题目】研究煤的合理利用及 CO2的综合应用有着重要的意义。请回答以下问题:
I.煤的气化
已知煤的气化过程涉及的基本化学反应有:
①C(s)+H2O(g) ![]() CO(g)+H2(g) △H=+131kJ·mol-1
CO(g)+H2(g) △H=+131kJ·mol-1
②CO(g)+3H2(g) ![]() CH4(g) +H2O(g) △H=akJ·mol-1
CH4(g) +H2O(g) △H=akJ·mol-1
查阅资料反应②中相关化学键能数据如下表:
化学键 | C≡O | H—H | H—C | H—O |
E(kJ·mol-1) | 1072 | 436 | 414 | 465 |
(1)则反应②中 a =_____________。
(2)煤直接甲烷化反应 C(s) + 2 H2 (g) ![]() CH4(g) 的△H=为 _____kJ mol-1, 该反应在_____________(填“高温”或“低温 ”)下自发进行。
CH4(g) 的△H=为 _____kJ mol-1, 该反应在_____________(填“高温”或“低温 ”)下自发进行。
II.合成低碳烯烃
在体积为1 L 的 密闭容器中,充入 1mol CO2和 2 .5 mol H2, 发生 反应: 2CO2 ( g) + 6 H2(g)![]() C2H4(g)+4 H2O(g) △H=-128kJ·mol-1,测得温度对催化剂催化效率和CO2 平衡转化率的影响如右图 所 示 :
C2H4(g)+4 H2O(g) △H=-128kJ·mol-1,测得温度对催化剂催化效率和CO2 平衡转化率的影响如右图 所 示 :
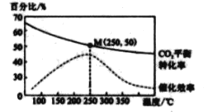
(3) 图中低温时, 随着温度升高催化剂的催化效率提高, 但 CO2的平衡转化率却反而降低 ,其原因是_______________.
(4) 250℃时,该反应的平衡常数K 值为____________。
III.合成甲醇
在恒温 2 L 容积不变的密闭容器中,充入 1molCO2 和 3 molH2, 发生反应:. CO2(g)+3H2(g) ![]() CH3OH(g)+ H2O(g),测得不同时刻反应前后容器内压强变化(p后/p前)如下表:
CH3OH(g)+ H2O(g),测得不同时刻反应前后容器内压强变化(p后/p前)如下表:
时间/h | 1 | 2 | 3 | 4 | 5 | 6 |
p后/p前 | 0.90 | 0.85 | 0.82 | 0.81 | 0.80 | 0.80 |
(5) 反应前 1 小时内的平均反应速率 v(H2)为_______molL-1h-1 , 该温度下CO2的平衡转化率为_____________。
【答案】-206 -75 低温 该反应为放热反应,温度升高,平衡逆向移动,所以二氧化碳的转化率降低 1 0.3 40%
【解析】
(1)焓变△H=反应物的总键能-生成物的总键能=a=1072 kJ/mol +3×436 kJ/mol -(4×414 kJ/mol +2×465 kJ/mol)=-206kJ/mol,故答案为:-206;
(2)由盖斯定律,方程式①+②得到C(s) + 2H2 (g)![]() CH4(g),则△H=-75 kJ/mol,反应△H<0,△S<0,则低温下能使△H-T△S<0,所以低温能自发进行,故答案为:-75;低温;
CH4(g),则△H=-75 kJ/mol,反应△H<0,△S<0,则低温下能使△H-T△S<0,所以低温能自发进行,故答案为:-75;低温;
(3)该反应为放热反应,温度升高,平衡逆向移动,则二氧化碳的平衡转化率降低,故答案为:该反应为放热反应,温度升高,平衡逆向移动,所以二氧化碳的转化率降低;
(4)250℃时,二氧化碳的平衡转化率为50%,可列三段式为:
2CO2 ( g) + 6 H2(g)![]() C2H4(g)+4 H2O(g)
C2H4(g)+4 H2O(g)
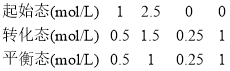
![]() ,故答案为:1;
,故答案为:1;
(5)在恒温2L容积不变的密闭容器中,充入1molCO2和3molH2,发生反应,设1h消耗二氧化碳的物质的量为x,则有三段式:
CO2(g)+3H2(g) ![]() CH3OH(g)+ H2O(g)
CH3OH(g)+ H2O(g)
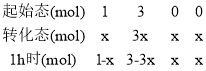
气体压强之比等于气体的物质的量之比,则![]() ,x=0.2mol,氢气的反应速率
,x=0.2mol,氢气的反应速率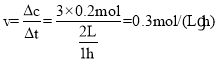 ;
;
平衡状态下气体压强之比为0.8,设消耗二氧化碳的物质的量为y,则有三段式:
CO2(g)+3H2(g) ![]() CH3OH(g)+ H2O(g)
CH3OH(g)+ H2O(g)
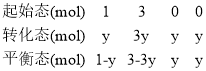
![]() ,y=0.4,二氧化碳的平衡转化率=
,y=0.4,二氧化碳的平衡转化率= ![]() ,故答案为:0.3;40%。
,故答案为:0.3;40%。

 阅读快车系列答案
阅读快车系列答案