题目内容
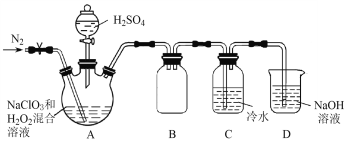
【题目】某同学设计了如图所示的实验装置探究将SO2、Cl2同时通入水中发生的反应。

(1)H装置中主要发生的离子方程式为__,I仪器的作用是__。
(2)若H中Cl2和SO2恰好完全反应,为了检验溶液中的阴离子,补充完整实验操作,并写出结论:取少量H中溶液于洁净的试管中,__。
【答案】Cl2+SO2+2H2O=4H++2Cl-+SO42- 防止倒吸 向其中加入过量的Ba(NO3)2溶液,产生白色沉淀则含有SO42-,过滤后取少量滤液,加入AgNO3溶液,产生白色沉淀,加入稀硝酸后沉淀不消失则含有Cl-
【解析】
(1)H装置中主要的反应是氯气和二氧化硫在溶液中生成盐酸和硫酸,根据SO2易溶于水分析;
(2)若H中Cl2和SO2恰好完全反应,溶液的阴离子为Cl-、SO42,根据银离子对硫酸根离子的干扰分析。
(1) H装置中主要反应的离子方程式为:Cl2+SO2+2H2O=4H++2Cl-+SO42,SO2易溶于水;I仪器的作用是防倒吸;
(2)若H中Cl2和SO2恰好完全反应,溶液的阴离子为Cl-、SO42,先检验SO42,后检验Cl-,则结论为:取少量H中溶液于洁净的试管中,向其中加入过量的Ba(NO3)2溶液,产生白色沉淀则含有SO42-,过滤后取少量滤液,加入AgNO3溶液,产生白色沉淀,加入稀硝酸后沉淀不消失则含有Cl-。

练习册系列答案
相关题目