题目内容
6.下列化学用语书写正确的是( )| A. | 纯碱溶液呈碱性的原因是:CO32-+2H2O?H2CO3+2OH- | |
| B. | 电解MgCl2水溶液的离子方程式:2Cl-+2 H2O $\frac{\underline{\;通电\;}}{\;}$H2↑+Cl2↑+2OH- | |
| C. | 质量数之和是质子数之和两倍的水分子符号可能是:D216O | |
| D. | 固体酒精是餐桌上常用的燃料,已知酒精的标准燃烧热是-1366.8kJ•mol-1,则表示酒精标准燃烧热的热化学方式式为: C2H5OH(s)+3O2(g)=2CO2(g)+2 H2O(l)△H=-1366.8kJ•mol-1 |
分析 A、盐的水解是分步进行的,第一步为主;
B、镁离子与氢氧根离子结合成氢氧化镁沉淀;
C、根据质量数=质子数+中子数进行判断;
D、酒精的标准燃烧热中的酒精对应的是液体酒精而不是固体酒精.
解答 解:A、CO32-水解应分两步进行,以第一步为主,所以CO32-+H2O?HCO3-+OH-,故A错误;
B、电解MgCl2水溶液的反应为:Mg2++2Cl-+2 H2O $\frac{\underline{\;通电\;}}{\;}$H2↑+Cl2↑+Mg(OH)2↓,故B错误;
C、D216O中质子数为10,原子质量数之和为16+4=20,质量数之和是质子数之和的2倍,故C正确;
D、酒精的标准燃烧热中的酒精对应的是液体酒精而不是固体酒精,故D错误;
故选C.
点评 本题考查化学用语的正误判断,意在考查考生对中学化学基础知识正确复述、再现、辨认的能力.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
16.铬铁矿是主要成分可表示为FeO•Cr2O3,还含有还含有MgO、Al2O3、Fe2O3等杂质,以下是以铬铁矿为原料制备重铬酸钾(K2Cr2O7)的工艺流程.
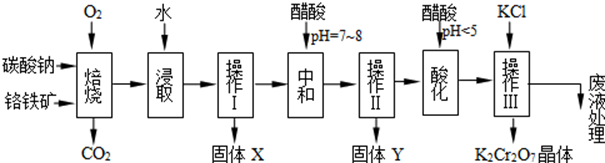
已知1:
①4FeO•Cr2O3+8Na2CO3+7O2 $\stackrel{750℃}{→}$8Na2CrO4+2Fe2O3+8CO2↑;
②Na2CO3+Al2O3 $\stackrel{750℃}{→}$2NaAlO2+CO2↑;
③Cr2O72-+H2O?2CrO42-+2H+
根据题意回答下列问题:
(1)操作I的名称是过滤.
(2)下表是相关物质的溶解度数据,操作Ⅲ发生反应的化学方程式是:Na2Cr207+2KCl=K2Cr207↓+2NaCl,该反应在溶液中能发生的理由是Na2Cr207的溶解度比K2Cr207大
(3)操作Ⅲ有多步组成,获得K2Cr207晶体的操作依次是:加入KC1固体、蒸发浓缩、冷却结晶、过滤、洗涤、干燥.
(4)副产品Y主要含氢氧化铝,还含少量镁、铁的难溶化合物及可溶性杂质,精确分析Y中氢氧化铝含量的方法是:称取n g样品,加入过量NaOH溶液 (写试剂)、溶解、过滤、再通入足量CO2气体…灼烧、冷却、称量,得干燥固体m g.计算样品中氢氧化铝的质量分数为$\frac{26n}{17m}$ (用含m、n的代数式表示).
(5)称取重铬酸钾试样2.500g配成250mL溶液,取出25mL与碘量瓶中,加入10mL 2mol/L H2SO4和足量碘化钾,放于暗处5min.然后加入100mL水,加入3mL 淀粉指示剂,用0.1000mol/LNa2S203标准溶液滴定,若实验中共用去Na2S203标准溶液47.40mL,则所得产品中重铬酸钾的纯度为92.9%.(保留3位有效数字)
已知:
①K2Cr2O7的摩尔质量为294g/mol
②Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O;
I2+2S2O32-=2I-+S4O62-.

已知1:
①4FeO•Cr2O3+8Na2CO3+7O2 $\stackrel{750℃}{→}$8Na2CrO4+2Fe2O3+8CO2↑;
②Na2CO3+Al2O3 $\stackrel{750℃}{→}$2NaAlO2+CO2↑;
③Cr2O72-+H2O?2CrO42-+2H+
根据题意回答下列问题:
(1)操作I的名称是过滤.
(2)下表是相关物质的溶解度数据,操作Ⅲ发生反应的化学方程式是:Na2Cr207+2KCl=K2Cr207↓+2NaCl,该反应在溶液中能发生的理由是Na2Cr207的溶解度比K2Cr207大
| 物质 | KCl | NaCl | K2Cr2O7 | Na2Cr2O7 | |
| 溶解度(g/100g水) | 0℃ | 28 | 35.7 | 4.7 | 163 |
| 40℃ | 40.1 | 36.4 | 26.3 | 215 | |
| 80℃ | 51.3 | 38 | 73 | 376 | |
(4)副产品Y主要含氢氧化铝,还含少量镁、铁的难溶化合物及可溶性杂质,精确分析Y中氢氧化铝含量的方法是:称取n g样品,加入过量NaOH溶液 (写试剂)、溶解、过滤、再通入足量CO2气体…灼烧、冷却、称量,得干燥固体m g.计算样品中氢氧化铝的质量分数为$\frac{26n}{17m}$ (用含m、n的代数式表示).
(5)称取重铬酸钾试样2.500g配成250mL溶液,取出25mL与碘量瓶中,加入10mL 2mol/L H2SO4和足量碘化钾,放于暗处5min.然后加入100mL水,加入3mL 淀粉指示剂,用0.1000mol/LNa2S203标准溶液滴定,若实验中共用去Na2S203标准溶液47.40mL,则所得产品中重铬酸钾的纯度为92.9%.(保留3位有效数字)
已知:
①K2Cr2O7的摩尔质量为294g/mol
②Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O;
I2+2S2O32-=2I-+S4O62-.
17.一般情况下,铜粉不溶于稀硫酸,但添加某物质后,则可反应生成硫酸铜(必要时可以加热).加入下列物质时,肯定不能促使铜粉溶解的是( )
| A. | H2O2 | B. | FeCl3 | C. | O2 | D. | FeCl2 |
14.如图所示的方案可以降低铁闸门的腐蚀速率.下列判断正确的是( )
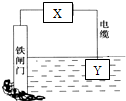

| A. | 若X为导线,Y可以是锌 | |
| B. | 若X为导线,铁闸门上的电极反应式为Fe-2e→Fe2+ | |
| C. | 若X为直流电源,铁闸门做负极 | |
| D. | 若X为直流电源,Y极上发生还原反应 |
1.下列有关(NH4)2Fe(SO4)2溶液的叙述正确的是( )
| A. | 该溶液中,Na+、H+、Cl-、NO3-可以大量共存 | |
| B. | 和新制氯水反应的离子方程式:Fe2++Cl2=Fe3++2Cl- | |
| C. | 加入NaOH溶液至Fe2+刚好沉淀完全的离子方程式:Fe2++2OH-=Fe(OH)2↓ | |
| D. | 离子浓度关系:c(SO42-)=c(NH4+ )>c(Fe2+ )>c(H+ )>c(OH-) |
11.短周期主族元素X、Y、W、Z的原子序数依次增大.其中X、Z同主族,Z的单质是一种良好的半导体材料,W3+与Y2-具有相同的核外电子数.下列叙述正确的是( )
| A. | Y2-的离子半径大于W3+的离子半径 | |
| B. | Y、Z形成的化合物为离子化合物 | |
| C. | Z的最高价氧化物对应的水化物的酸性比X的强 | |
| D. | X的气态简单氢化物的稳定性比Y的强 |
16.设阿伏加德罗常数为NA,则下列说法正确的是( )
| A. | 常温常压下,11.2LCH4中含有的氢原子数为2NA | |
| B. | 标准状况下,0.3mol二氧化硫中含有氧原子数为0.3NA | |
| C. | 2.7g铝与足量的盐酸反应,失去的电子数为0.3NA | |
| D. | 0.1mol/L MgCl2溶液中含Mg2+数为0.2NA |

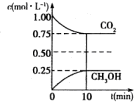 (1)二氧化碳是引起“温室效应”的主要物质,节能减排,高效利用能源,能够减少二氧化碳的排放.在一定温度下的2L固定容积的密闭容器中,通入2molCO2和3molH2,发生的反应为CO2(g)+3H2(g) CH3OH(g)+H2O(g),△H=-aKJ•mol-1(a>0),测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示.
(1)二氧化碳是引起“温室效应”的主要物质,节能减排,高效利用能源,能够减少二氧化碳的排放.在一定温度下的2L固定容积的密闭容器中,通入2molCO2和3molH2,发生的反应为CO2(g)+3H2(g) CH3OH(g)+H2O(g),△H=-aKJ•mol-1(a>0),测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示.